| Скачать .docx | Скачать .pdf |
Реферат: Цитология и строение клетки
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ЧЕЛЯБИНСКИЙ ГОСУДАРСТВЕННЫЙ ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ»
Естественно – технологический факультет
кафедра биологии
Контрольная работа
по предмету: «Цитология»
Вариант № 6
Цитология и строение клетки
Выполнила:
Гырдымова Светлана Владимировна
студентка 3 курса
2б группы
спец. «биология – педагогика -психология»
Научный руководитель:
Челябинск
2010
Оглавление
Вопрос 1. 3
Вопрос 2. 13
Вопрос 3. 18
Список использованной литературы.. 21
Вопрос 1
Методы изучения клетки: микроспектромериз, цитофотометрия, флуоресцентная и ультрафиолетовая микроскопия. Метод чисторадиографии
Методы микроскопии выбираются (и обеспечиваются конструктивно) в зависимости от характера и свойств изучаемых объектов, так как последние влияют на контрастность изображения.
Микроспектромериз
Метод светлого поля и его разновидности
Метод светлого поля в проходящем свете применяется при изучении прозрачных препаратов с включенными в них абсорбирующими (поглощающими свет) частицами и деталями. Это могут быть, например, тонкие окрашенные срезы животных и растительных тканей, тонкие шлифы минералов и т. д.
В отсутствие препарата пучок света из конденсора, проходя через объектив, даёт вблизи фокальной плоскости окуляра равномерно освещенное поле. При наличии в препарате Абсорбирующего элемента происходит частичное поглощение и частичное рассеивание падающего На него света, что и обусловливает появление изображения.
Метод косого освещения - разновидность предыдущего метода. Отличие между ними состоит в том, что свет на объект направляют под большим углом к направлению наблюдения. Иногда это помогает выявить «рельефность» объекта за счёт образования теней.
Метод светлого поля в отражённом свете применяется при исследовании непрозрачных отражающих свет объектов, например шлифов металлов или руд.
Освещение препарата (от осветителя и полупрозрачного зеркала) производится сверху, через объектив, который одновременно играет и роль конденсора.
В изображении, создаваемом в плоскости объективом совместно с тубусной линзой, структура препарата видна из-за различия в отражающей способности её элементов; на светлом поле выделяются также неоднородности, рассеивающие падающий на них свет.
Метод темного поля и его разновидности
Метод тёмного поля в проходящем свете используется для получения изображений прозрачных неабсорбирующих объектов, которые не могут быть видны, если применить метод светлого поля. Зачастую это биологические объекты.
Свет от осветителя и зеркала направляется на препарат конденсором специальной конструкции — т. н. конденсором тёмного поля. По выходе из конденсора основная часть лучей света, не изменившая своего направления при прохождении через прозрачный препарат, образует пучок в виде полого конуса и не попадает в объектив (который находится внутри этого конуса). Изображение в микроскопе формируется при помощи лишь небольшой части лучей, рассеянных микрочастицами находящегося на предметном стекле препарата внутрь конуса и прошедшими через объектив.
В поле зрения на тёмном фоне видны светлые изображения элементов структуры препарата, отличающихся от окружающей среды показателем преломления. У крупных частиц видны только светлые края, рассеивающие лучи света.
Используя этот метод, нельзя определить по виду изображения, прозрачны частицы или непрозрачны, больший или меньший показатель преломления они имеют по сравнению с окружающей средой.
В основе метода ультрамикроскопии лежит тот же принцип – препараты в ультрамикроскопах освещаются перпендикулярно направлению наблюдения. При этом методе можно обнаружить (но не «наблюдать») чрезвычайно мелкие частицы.
С помощью иммерсионных ультрамикроскопов удаётся зарегистрировать присутствие в препарате частиц размером до 2*10-9 м. Но форму и точные размеры таких частиц с помощью этого метода определить невозможно. Непрозрачные препараты (например, шлифы металлов), наблюдаемые по методу тёмного поля в отражённом свете освещают сверху — через специальную кольцевую систему, расположенную вокруг объектива и называемую эпиконденсором.
Цитофотометрия
Цитофотометрия - является современной технологией быстрого оптического измерения параметров клетки, ее органелл и происходящих в ней процессов.
Методика заключается в выявлении рассеяния света лазерного луча при прохождении через него клетки в струе жидкости, причём, степень световой дисперсии позволяет получить представление о размерах и структуре клетки. Кроме того, в ходе анализа учитывается уровень флуоресценции химических соединений, входящих в состав клеточной стенки (аутофлуоресценция) или внесённых в образец перед проведением цитометрии.
Принцип метода. Клеточная суспензия, предварительно меченная флюоресцирующими моноклональными антителами или флуоресцентными красителями, попадает в поток жидкости, проходящий через проточную ячейку.
Условия подобраны таким образом, что клетки выстраиваются друг за другом за счет т. н. гидродинамического фокусирования струи в струе. В момент пересечения клеткой лазерного луча детекторы фиксируют:
1. рассеяние света под малыми углами (от 1° до 10°) (данная характеристика используется для определения размеров клеток).
2. рассеяние света под углом 90° (позволяет судить о соотношении ядро/цитоплазма, а так же о неоднородности и гранулярности клеток).
3. интенсивность флуоресценции по 4-ем каналам флуоресцентности (позволяет определить субпопуляционный состав клеточной суспензии и др.)
Наиболее часто используемые флуорохромы
– флуоресцеина изотиоцианат (FITC)
– Фикоэритрин (PE, RD1)
– Перидинин-Хлорофилл Протеин (Per-CP)
– Алофикоцианин (APC)
Тандемные красители:
– Фикоэритрин - Техасский красный (ECD)
– Фикоэритрин - Cy5 (PC5)
– Фикоэритрин - Cy7 (PC7)
Преимущества метода
– короткое время анализа (сек) за счет высокой скорости
– анализ большого количества клеток (до 107 клеток)
– логические ограничения допускают детектирование субпопуляций клеток
– измерение параметров редко встречающихся клеток
– объективное измерение интенсивности флуоресценции
Область применения в цитологии:
1. определение цитоморфологической принадлежности клетки размер, соотношение ядро/цитоплазма, степень асимметричности и гранулярности клеток
2. оценка активности внутриклеточных ферментов с помощью флуорогенных субстратов
3. определение экспрессии поверхностных антигенов
4. анализ стадий клеточного цикла
5. измерение физиологических параметров клетки (внутриклеточный pH, концентрация свободных ионов Ca2+, потенциал наружной клеточной мембраны)
Флуоресцентная микроскопия
Флуоресцентная микроскопия - высокочувствительный микроскопический метод (анализ проводится как в отраженном, так и в проходящем свете), основанный на обработке тестируемого материала красителями-флуорохромами. Флуоресцирующие (окрашенные) зоны выглядят при флуоресцентной микроскопии как яркие участки на темном фоне.
Основана на способности некоторых веществ люминесцировать, т. е. светиться при освещении невидимым ультрафиолетовым или синим светом. Цвет люминесценции смещен в более длинноволновую часть спектра по сравнению с возбуждающим ее светом (правило Стокса).
При возбуждении люминесценции синим светом цвет ее может быть от зеленого до красного, если люминесценция возбуждается ультрафиолетовым излучением, то свечение может быть в любой части видимого спектра.
Эта особенность люминесценции позволяет, используя специальные светофильтры, поглощающие возбуждающий свет, наблюдать сравнительно слабое люминесцентное свечение.
Устройство флуоресцентного микроскопа и правила работы с ним отличаются от обычного светового микроскопа в основном следующим:
1. Наличие мощного источника света в осветителе, излучающего преимущественно в коротковолновой (ультрафиолетовой, синей) части спектра (ртутно-кварцевая лампа или галогенная кварцевая лампа).
2. Наличие системы светофильтров:
· возбуждающие светофильтры пропускают только ту часть спектра, которая возбуждает люминесценцию;
· теплозащитный светофильтр защищает от перегрева другие светофильтры, препарат и оптику флуоресцентного микроскопа;
· "запирающие" светофильтры расположены между окуляром. Эти светофильтры поглощают возбуждающее излучение и пропускают свет люминесценции от препарата к глазу наблюдателя.
Способ освещения препаратов для возбуждения люминесценции заключается в том, что препарат освещают светом, падающим на него через объектив. Благодаря этому освещенность увеличивается при использовании объектов, имеющих большую числовую апертуру, т. е. тех, которые используются для изучения микроорганизмов.
Важную роль при этом способе освещения играет специальная интерференционная светоделительная пластинка, направляющая свет в объектив. Она представляет собой полупрозрачное зеркало, которое избирательно отражает и направляет в объектив часть спектра, которая возбуждает люминесценцию, а пропускает в окуляр свет люминесценции.
Оптика объективов флуоресцентного микроскопа изготавливается из нелюминесцирующих сортов оптического стекла и склеивается специальным нелюминесцирующим клеем. При работе с объективами масляной иммерсии используется нелюминесцирующее иммерсионное масло.
Поскольку большинство микроорганизмов не обладают собственной люминесценцией существует несколько способов их обработки для наблюдения в флуоресцентном микроскопе. Прежде всего, это флуорохромирование - окрашивание сильно разведенными (до нескольких микрограмм/мл) растворами флуоресцирующих красителей (флуорохромов). Флуоресцентная микроскопия по сравнению с обычной позволяет:
- сочетать цветное изображение и контрастность объектов;
- изучать морфологию живых и мертвых клеток микроорганизмов в питательных средах и тканях животных и растений;
- исследовать клеточные микроструктуры, избирательно поглощающие различные флуорохромы, являющиеся при этом специфическими цитохимическими индикаторами;
- определять функционально-морфологические изменения клеток;
- использовать флуорохромы при иммунологических реакциях и подсчете бактерий в образцах с невысоким их содержанием.
Флюоресцентная (люминесцентная) микроскопия позволяет изучать как собственную (первичную) флюоресценцию ряда веществ, так и вторичную флюоресценцию, вызванную окрашиванием клеточных структур специальными красителями — флюорохромами.
Принцип метода состоит в том, что некоторые вещества при световом облучении начинают светиться сами. Для возбуждения флюоресценции в видимой части спектра обычно пользуются синим светом или ультрафиолетовыми лучами.
Многие вещества, не флюоресцирующие в видимой области (в особенности нуклеиновые кислоты), при освещении ультрафиолетовыми лучами начинают флюоресцировать и могут выявляться без применения флюорохромов.
К вторичной флюоресценции относится иммунофлюоресценция, основанная на взаимодействии иммунного белка с флюорохромами.
Ультрафиолетовая микроскопия
Ультрафиолетовая микроскопия, основанная на способности некоторых веществ избирательно поглощать ультрафиолетовые лучи с определенной длиной волны, принципиально почти ничем не отличается от обычной световой микроскопии и осуществляется при помощи микроскопов с кварцевой или отражательной (зеркальной) оптикой. Изображение рассматривается на флюоресцирующем экране визуально, а также фотографируется.
Микроскопирование объектов позволяет выявить исследуемые вещества, не применяя окрашивания.
Поскольку крайний предел разрешения, достижимый с наилучшей линзой, равен половине длины волны применяемого света, единственным возможным путем увеличения разрешения может быть использование света более коротких длин волн, чем видимый.
Таким светом является ультрафиолетовое излучение. Длина волны зеленого света составляет 5000 А. Из соображений, обусловленных источниками света и используемыми для линз материалами, самый коротковолновый реально применимый на практике ультрафиолетовый свет — это мощное излучение ртутной дуги, длина волны которого очень близка к 2500
А, т. е. как раз к половине длины волны зеленого света. В самом лучшем случае использование этого ультрафиолетового света может только удвоить разрешающую способность; достижение не такое уж значительное, тем не менее достаточно желательное.
Однако существует иное и, может быть, большее основание пользоваться ультрафиолетовым светом в микроскопии, оеобенно в применении к биологическим объектам.
Было найдено, что различные участки образца могут (на самом деле это совсемно редкий случай) поглощать ультрафиолетовый свет по-разному. Вследствие этого прохождение света через объект может выявить совершенно новые контрасты и обнаружить области различной структуры при условии, что существует какое-нибудь устройство, позволяющее наблюдателю «увидеть» ультрафиолетовое изображение.
В наше время ультрафиолетовые микроскопы изготовляются оптической промышленностью.
При этом «приходится решать три задачи.
Необходимо создать безвредные для здоровья интенсивные источники ультрафиолетового излучения, которые не излучали бы видимого света; в противном случае видимый свет будет маскировать искомые эффекты.
В настоящее время этой цели служит ртутная дуга в кварцевой оболочке, поскольку кварц прозрачен в требуемой области длин волн (обычное стекло для такого света непрозрачно).
Источник помещается в контейнер из специального стекла, которое обладает нужным свойством задерживать видимый свет, но пропускать значительную часть ультрафиолета.
Метод чисторадиографии
Метод чисторадиографии основан на действии излучений, испускаемых радиоизотопами, на фотопластинку. Он применяется как один из способов качественного и количественного определения радиоактивности горных пород и минералов.
Различают две разновидности метода: обычную, или контрастную, радиографию и следовую, или микроавторадиографию. При обычной радиографии изучаемый образец отшлифовывается, накладывается на эмульсию фотопластинки, закрепляется на ней и экспонируется в темноте в течение определенного времени, зависящего от активности образца.
Чем выше радиоактивность образца, тем интенсивнее (после проявления) почернение фотопластинки. Такая радиография дает возможность решить вопрос о распределении в образце радиоактивных элементов и оценить их суммарное содержание путем сравнения с эталонным образцом. В контрастной радиографии используется действие α-, β- и отчасти γ-излучения.
Способность сильно ионизирующих α-частиц оставлять в проявленной пластинке четкие прямолинейные следы (треки), видимые под микроскопом примерно при 500-кратном увеличении, используется в микроавторадиографии.
Для трековой авторадиографии используются специальные фотопластинки с толстым слоем эмульсии (не менее 50 мкм) и большой концентрацией бромистого серебра, не чувствительные к β- и γ-излучению, но четко фиксирующие α-частицы различных энергий, а следовательно, различных пробегов R. Определение пробегов необходимо для изучения природы радиоактивности и раздельного измерения урана и тория.
Вопрос 2
Способы деления клеток. Сходства и различия митотического, редукционного и эквационного деления клетки. Приведите примеры клеток, размножающихся посредством указанных видов деления
Деление клеток - основа размножения и индивидуального развития организмов. Жизненный цикл клетки. Митотический цикл клетки, митоз (амитоз).
Жизнь клетки завершается делением или, как у многоклеточных организмов, старением и смертью. Только благодаря способности воспроизводить себе подобных осуществляется преемственность и непрерывность жизни на Земле. В основе размножения и индивидуального развития организмов лежит непрерывная серия клеточных делений.
Способы деления клеток представлены в схеме:
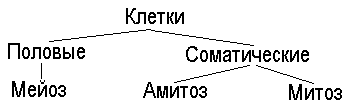
Результат деления клетки - появление двух дочерних из одной материнской. Этот процесс циклически повторяется, совершаясь через строго определенное время. Разные виды клеток обладают разной скоростью и способностью к делению.
Время существования клетки от деления к делению называют жизненным циклом клетки.
Перед изучением этой темы повторите содержание понятий: ДНК, хромосомы, хроматиды, клеточный центр, кариотип, гомологичные хромосомы, постоянство числа хромосом.
Клеточный цикл эукариот состоит из интерфазы и мтоза. В период интерфазы в клетке происходят следующие процессы:
1) удвоение хромосом - редупликация ДНК (удвоенная хромосома состоит из двух хроматид, каждая из которых содержит одну молекулу ДНК).
2) биосинтез белков, накопление АТФ, Удвоение важнейших структур клетки.
Вслед за интерфазой наступает относительно короткий период в жизни клетки при котором происходит равномерное распределение хромосом и цитоплазмы по двум дочерним клеткам - МИТОЗ.
Митоз представляет собой сложное деление с образованием специального аппарата для равномерного распределения хромосом по дочерним клеткам (митотического веретена). В митозе условно можно выделить несколько последовательных фаз: профаза, метафаза, анафаза, телофаза.
Биологическое значение митоза заключается в том, что он обеспечивает постоянство числа хромосом во всех клетках организма. В процессе митоза происходит распределение ДНК хромосом материнской клетки строго поровну между возникающими из нее двумя дочерними клетками. В результате митоза все клетки тела, кроме половых, получают одну и ту же генетическую информацию. Такие клетки называются соматическими (от греч. "сома" - тело).
Митотическое деление клеток (митоз) приводит к увеличению числа клеток, росту организма. Таким способом обеспечивается обновление клеток при их износе, гибели. В настоящее время известно, что клетки эпидермиса живут 10-30 дней, эритроциты - до 4-5 мес. Нервные и мышечные клетки (волокна) живут в течение всей жизни человека. У всех клеток при размножении (делении) наблюдаются изменения, укладывающиеся в рамки клеточного цикла. Клеточным циклом называют процессы, которые происходят в клетке от деления до деления или от деления до смерти (гибели) клетки. В клеточном цикле выделяют подготовку клетки к делению (интерфаза) и митоз (процесс деления клетки).
В интерфазе, которая длится примерно 20-30 ч, скорость биосинтетических процессов возрастает, увеличивается количество органелл. В это время удваивается масса клетки и всех ее структурных компонентов, в том числе центриолей. Происходит репликация (повторение, удвоение) молекул нуклеиновых кислот. Этот процесс передачи генетической информации, хранящейся в родительской ДНК, путем точного ее воспроизведения в дочерних клетках. Родительская цепь ДНК служит матрицей для синтеза дочерних ДНК. В итоге репликации каждая из двух дочерних молекул ДНК состоит из одной старой и одной новой цепей. В период подготовки к митозу в клетке синтезируются белки, необходимые для деления клетки. К концу интерфазы хроматин в ядре конденсирован.
Мейоз (или редукционное деление клетки) — деление ядра эукариотической клетки с уменьшением числа хромосом в два раза. Происходит в два этапа (редукционный и эквационный этапы мейоза). Мейоз не следует смешивать с гаметогенезом — образованием специализированных половых клеток, или гамет, из недифференцированных стволовых.
С уменьшением числа хромосом в результате мейоза в жизненном цикле происходит переход от диплоидной фазы к гаплоидной. Восстановление плоидности (переход от гаплоидной фазы к диплоидной) происходит в результате полового процесса.
В связи с тем, что в профазе первого, редукционного, этапа происходит попарное слияние (конъюгация) гомологичных хромосом, правильное протекание мейоза возможно только в диплоидных клетках или в чётных полиплоидах (тетра-, гексаплоидных и т. п. клетках). Мейоз может происходить и в нечётных полиплоидах (три-, пентаплоидных и т. п. клетках), но в них, из-за невозможности обеспечить попарное слияние хромосом в профазе I, расхождение хромосом происходит с нарушениями, которые ставят под угрозу жизнеспособность клетки или развивающегося из неё многоклеточного гаплоидного организма.
Этот же механизм лежит в основе стерильности межвидовых гибридов. Поскольку у межвидовых гибридов в ядре клеток сочетаются хромосомы родителей, относящихся к различным видам, хромосомы обычно не могут вступить в конъюгацию. Это приводит к нарушениям в расхождении хромосом при мейозе и, в конечном счете, к нежизнеспособности половых клеток, или гамет. Определенные ограничения на конъюгацию хромосом накладывают и хромосомные мутации (масштабные делеции, дупликации, инверсии или транслокации).
Второе деление мейоза (эквационное)
Второе мейотическое деление следует сразу же после первого и сходно с обычным митозом. Второе деление мейоза состоит из тех же стадий, что и митоз, с тем отличием, что в каждой клетке находится не диплоидное, а гаплоидное число хромосом.
Второе деление мейоза проходит гораздо быстрее первого и обычно занимает несколько часов. В целом же мейоз – значительно более длительный процесс по сравнению с митозом: у ржи он идет более двух суток, у дрозофилы – около недели, у человека – три с половиной недели.
Профаза II. Профаза II непродолжительна. При втором делении мейоза, в профазе II, хромосомы спирализуются, ядерные мембраны исчезают, в каждой клетке формируется веретено деления. Формула клеток №2с.
Метафаза II. В метафазе II хромосомы располагаются на экваторе. Как и во время метафазы митоза, центромеры хромосом находятся на экваторе клетки, а плечи хроматид направлены к полюсам. Формула клеток сохраняется (n2с).
Анафаза II. В анафазе II центромеры хромосом делятся, хроматиды расходятся, происходит случайное комбинирование хроматид негомологичных хромосом у полюсов (третий эффект мейоза), что также приводит к появлению новых комбинаций неаллельных генов. Формула этих клеток 2n2с.
Телофаза II. В телофазе II хромосомы деспирализуются, образуются ядерные мембраны, клетки делятся.
Таким образом, после второго деления мейоза из каждой гаплоидной клетки с двойным набором хроматид (n2с) возникают две гаплоидные клетки с одинарным набором хроматид (nc), отличные друг от друга по набору генетического материала (генов).
Следовательно, клетки, образующиеся в результате мейоза, гаплоидны, и содержат по одному гену из каждой аллельной пары (одинарный набор генов диплоидного организма).
Биологический смысл мейоза состоит в том, что из одной диплоидной клетки образуются четыре уникальные (по набору генов) гаплоидные клетки (не похожие друг на друга и на материнскую клетку по набору генетического материала). Гаплоидными клетки получаются потому, что деления (первое деление мейоза и второе деление мейоза) происходит дважды, а синтез ДНК – только один раз. Уникальность набора генов каждой клетки достигается благодаря эффектам мейоза: кроссинговеру, независимому расхождению и комбинированию негомологичных хромосом при первом делении, а также независимому расхождению и комбинированию хроматид при втором делении. Уменьшение числа хромосом в половых клетках в два раза (n) и восстановление диплоидности (2n) при оплодотворении (слиянии половых клеток) в зиготе способствует генетической стабильности вида.
Вопрос 3
Функции биологических мембран. Трансмембранный перенос малых молекул: диффузия (пассивная и облегченная) и активный транспорт
Фосфолипидный бислой, как уже было сказано, составляет основу структуры мембраны. Он также ограничивает проникновение полярных молекул и ионов в клетку и выход их из нее. Ряд функций выполняют и другие компоненты мембран.
1. Белки-каналы и белки-переносчики осуществляют избирательный транспорт полярных молекул и ионов через мембрану (об активном транспорте и облегченной диффузии смотрите соответствующие статьи).
2. Ферменты. Белки нередко функционируют как ферменты. В качестве примера укажем на микроворсинки эпителия, выстилающего некоторые отделы кишечника. Плазматические мембран этих эпителиальных клеток содержат пищеварительные ферменты.
3. Рецепторные молекулы. У всех белковых молекул весьма специфическая конформация, о чем мы уже говорили в наших статьях. Это делает их идеальными рецепторами, т. е. молекулами, при помощи которых от клетки к клетке передаются те или иные сигналы. Например, гормоны являющиеся химическими посредниками, циркулируют в крови, но присоединяются они только к особым клеткам-мишеням, у которых есть соответствующие рецепторы. Нейромедиаторы — химические вещества, обеспечивающие проведение нервных импульсов, — тоже связываются с особыми рецепторными белками нервных клеток.
4. Антигены действуют как маркеры, своего рода «ярлыки», позволяющие опознать клетку. Это гликопротеины, т. е. белки с присоединенными к ним разветвленными олигосахаридными боковыми цепями, играющими роль «антенн». Существует бесчисленное множество возможных конфигураций этих боковых цепей, так что у каждой клетки может быть свой особый маркер. С помощью маркеров клетки способны распознавать другие клетки и действовать согласованно с ними, например при формировании тканей и органов у многоклеточных организмов. Это же свойство позволяет иммунной системе распознавать и атаковать чужеродные антигены.
5. У гликолипидов тоже имеются разветвленные олигосахаридные боковые цепи и они также помогают клеткам распознавать друг друга. Гликолипиды могут служить рецепторами для химических сигналов. Вместе с гликопротеинами гликолипиды обеспечивают правильное сцепление клеток при их объединении в ткани.
6. Перенос энергии. При фотосинтезе и дыхании в мембранах соответственно хлоропластов и митохондрий действуют системы переноса энергии, в которых также участвуют белки.
7. Холестерол служит дополнительным «стопором», препятствующим перемещению полярных молекул через мембрану в обоих направлениях — в клетку и из клетки.
Молекулы могут пассивно пересекать бислой по электрохимическому градиенту путем простой или облегченной диффузии. Такому спонтанному переносу, приводящему к установлению равновесия, противостоит активный транспорт, который требует затрат энергии, поскольку он происходит против электрохимического градиента.
Пассивный транспорт — перенос веществ по градиенту концентрации, без затрат энергии (например, диффузия, осмос). Диффузия — пассивное перемещение вещества из участка большей концентрации к участку меньшей концентрации. Осмос — пассивное перемещение некоторых веществ через полупроницаемую мембрану (обычно мелкие молекулы проходят, крупные не проходят).
При простой диффузии частицы вещества перемещаются сквозь липидный бислой. Направление простой диффузии определяется только разностью концентраций вещества по обеим сторонам мембраны. Путём простой диффузии в клетку проникают гидрофобные вещества (O2 ,N2 ,бензол) и полярные маленькие молекулы (CO2 , H2 O, мочевина). Не проникают полярные относительно крупные молекулы (аминокислоты, моносахариды), заряженные частицы (ионы) и макромолекулы (ДНК, белки).
Большинство веществ переносится через мембрану с помощью погружённых в неё транспортных белков (белков-переносчиков).
Все транспортные белки образуют непрерывный белковый проход через мембрану.
С помощью белков-переносчиков осуществляется как пассивный , так и активный транспорт веществ. Полярные вещества (аминокислоты, моносахариды), заряженные частицы (ионы) проходят через мембраны с помощью облегченной диффузии , при участии белков-каналов или белков-переносчиков. Участие белков-переносчиков обеспечивает более высокую скорость облегченной диффузии по сравнению с простой пассивной диффузией . Скорость облегченной диффузии зависит от ряда причин: от трансмембранного концентрационного градиента переносимого вещества, от количества переносчика, который связывается с переносимым веществом, от скорости связывания вещества переносчиком на одной поверхности мембраны (например, на наружной), от скорости конформационных изменений в молекуле переносчика, в результате которых вещество переносится через мембрану и высвобождается на другой стороне мембраны. Облегченная диффузия не требует специальных энергетических затрат за счет гидролиза АТФ. Эта особенность отличает облегченную диффузию от активного трансмембранного транспорта
Список использованной литературы
1. Биология. Общие закономерности. 9 класс (2003г.) "Дрофа". С.Г. Мамонтов, В.Б. Захаров, Н.И. Сонин.
2. Биология. Большой энциклопедический словарь / Гл.ред. М.С. Гиляров.-3-е изд.-М.:1998.
3. Биология. Пособие для поступающих в вузы. (1984г.) "Высшая школа" Э.В. Семенов, С.Г. Мамонтов, В.Л. Коган.
4. Биология. Введение в общую биологию и экологию. 9 класс. (2003г.). "Дрофа" А.А. Каменский, Е.А. Криксунов.
5. Большой Энциклопедический словарь. — М.: Большая российская энциклопедия, Просвещение, 1992. — 860 с.: ил. — ISBN 5-09-004171-7.
6. Мамонтов С.Г. Введение в цитологию . Учебник.-М.: Дрофа, 2004.
7. Найдыш В.М. Цитология: Учеб. Пособие.-М.: Гардарики, 2003.
8. Ченцов Ю.С. Общая цитология, 3-е изд. М., 1995 Грин Н., Стаут У., Тейлор Д. Биология, т. 1. М., 1996