| Скачать .docx | Скачать .pdf |
Реферат: Понятие радиоактивного распада. Методы регистрации ионизирующих излучений. Биологическое воздействие излучений на организм
Содержание
3. Сущность процессов ионизации и возбуждения атомов
14. Стицилляционный, химический и фотохимический методы обнаружения и регистрации ионизирующих излучений
24. Действие радиоактивных излучений на клетки
Список литературы
1. Сущность процессов ионизации и возбуждения атомов
Открытия радиоактивности подтвердило сложность строения не только атомов, а и их ядер. В 1903 г. Э. Резерфорд и Ф. Содди предложили теорию радиоактивного распада, которая коренным образом изменила старые взгляды на строение атомов. В соответствии с этой теорией, радиоактивные элементы самочинно распадаются с выпусканием α- или β-частинок и образованием атомов новых элементов, химически отличных от исходных. При этом сохраняется стабильность массы как исходных атомов, так и тех, которые образовались вследствие хода процесса распада. Э. Резерфорд в 1919 г. впервые исследовало искусственное преобразование ядер. Во время бомбардировки атомов Нитрогена с α-частинками он выделил ядра атомов Гидрогена (протоны) и атомы нуклида Оксигену. Такие преобразования называют ядерными реакциями, поскольку из ядер атомов одного элемента получаются ядра атомов других элементов. Ядерные реакции записывают с помощью уравнений. Так, рассмотренную выше ядерную реакцию можно записать так:
![]()
Определения явлению радиоактивности можно дать, использовав понятие об изотопах: радиоактивностью называется преобразование нестойких ядер атомов одного химического элемента на ядра атомов другого элемента, которое сопровождается выпусканием элементарных частичек. Радиоактивность, которую проявляют изотопы элементов, которые существуют в природе, называется естественной радиоактивностью.
Скорость радиоактивных преобразований разная для разных изотопов. Она характеризуется постоянной радиоактивного распада, которая показывает, сколько атомов радиоактивного нуклида распадается за 1 с Установлено, что количество атомов радиоактивного нуклида, которое распадается за единицу времени, пропорциональная общему количеству атомов этого нуклида и зависит от величины постоянной радиоактивного распада. Например, если на протяжении некоторого периода распалась половина общего количества атомов радиоактивного нуклида, то в следующий такой самый период распадется половина остатка, то есть вдвое меньше, чем за предыдущий период, и т.д.
Продолжительность жизни радиоактивного нуклида характеризуют периодом полураспада, то есть таким промежутком времени, на протяжении которого распадается половина начального количества этого нуклида. Например, период полураспада Радона составляет 3,85 суток, Радия - 1620 лет, Урану - 4,5 миллиарда лет.
Известные такие типы радиоактивных преобразований: α-распад, β-разпад, спонтанный (самочинный) деление ядер. Эти типы радиоактивных преобразований сопровождаются выпусканием α-частичек, электронов, позитронов, γ-луч.
В процессе α-распада ядро атома радиоактивного элемента выпускает ядро атома Гелия, вследствие чего заряд ядра атома исходного радиоактивного элемента уменьшается на две единицы, а массовое число - на четырех. Например, преобразования атома Радия на атом Радона можно записать уравнением
![]()
Ядерную реакцию β-распада, который сопровождается выпусканием электронов, позитронов или увлечением орбитальных электронов, также можно записать уравнением
![]()
где е- -электрон; hν - квант γ-излучения; νo - антинейтрино (элементарная частичка, масса покоя которой и заряд равняются нулю).
Возможность β-розпаду связана с тем, что, в соответствии с современными представлениями, нейтрон может превращаться при определенных условиях на протон, выпуская при этом электрон и антинейтрино. Протон и нейтрон - два состояния одной и той самой ядерной частички - нуклона. Этот процесс можно изобразить схемой
Нейтрон -> Протон + Электрон + Антинейтрино
В процессе β-распада атомов радиоактивного элемента один из нейтронов, который входит в состав ядра атома, выпускает электрон и антинейтрино, превращаясь на протон. В этом случае положительный заряд ядра увеличивается на единицу. Такой вид радиоактивного распада называется электронным -распадом (β- -распадом).
Итак, если ядро атома радиоактивного элемента выпускает одну α-частицу, получается ядро атома нового элемента с протонным числом на две единицы меньшим, а при выпускании β-частички - ядро нового атома с протонным числом на единицу большим, чем у исходного. В этом и состоит суть закона смещения Содди-Фаянса.
Ядра атомов некоторых нестабильных изотопов могут выпускать частички, которые имеют положительный заряд +1 и массу, близкую к массе электрона. Эта частичка называется позитроном. Итак, возможное преобразование протона на нейтрон согласно с схемой
Протон → Нейтрон + Позитрон + Нейтрино
Преобразования протона на нейтрон наблюдается лишь в том случае, когда нестабильность ядра вызванная избыточным содержимым в нем протонов. Тогда один из протонов превращается в нейтрон, а позитрон и нейтрино, которые возникают при этом, вылетают за границы ядра; заряд ядра уменьшается на единицу
Такой тип радиоактивного распада называется позитронным -распадом (β+-распадом).
Итак, вследствие β-розпаду ядра атома радиоактивного элемента получается атома элемента, смещенного на одно место вправо (β-розпад) или влево (β+-распад) от исходного радиоактивного элемента.
Уменьшения заряда ядра радиоактивного атома на единицу может быть вызвано не только β+-распадом, а и электронным увлечением, вследствие чего один из электронов ближайшего к ядру электронного шара захватывается ядром. Этот электрон с одним из протонов ядра образовывает нейтрон:
е- +р → n.
Теорию строения ядра атома разработали в 30-х годах XX ст. украинские ученые Д.Д. Иваненко и Е.М. Гапон, а также немецкий ученый В. Гейзенберг. В соответствии с этой теорией, ядра атомов состоят из положительно заряженных протонов и электронейтральных нейтронов. Относительные массы этих элементарных частичек почти одинаковые (масса протона 1,00728, масса нейтрона- 1,00866). Протоны и нейтроны (нуклоны) содержатся в ядре очень крепкими ядерными силами. Ядерные силы действуют только на очень маленьких расстояниях - порядка 10-15 м.
Энергия, которая выделяется во время образования ядра из протонов и нейтронов, называется энергией связи ядра и характеризует ее стабильность.
14. Стицилляционный, химический и фотохимический методы обнаружения и регистрации ионизирующих излучений
Современные сцинтилляционные счетчики подразделяют на счетчики с твердым и жидким сцинтилляторами. Жидкостно-сцинтилляционные счетчики предназначены для регистрации бета-излучения низкой энергии. Для регистрации гамма-излучения удобна использовать твердые сцинтилляторы. Сцинтиллятор — вещество, испускающее вспышки света при действии на него ионизирующей радиации.
Жидкие сцинтилляторы — это растворы, содержащие соединения, способные флуоресцировать под действием ионизирующей радиации. Наиболее широко в качестве такого соединения используют 2,5-дифенилоксазол (ППО). Радиоактивное соединенна вводят в сцинтиллятор, что обеспечивает наибольший его контакт с флуоресцирующим веществом.
В качестве твердых сцинтшгляторов чаще всего используют кристалл йодистого натрия, которому придают форму колодца. Под действием излучения молекулы кристаллической решетки подвергаются ионизации и возбуждению, сопровождающемуся световой вспышкой. Интенсивность вспышки зависит от энергии излучения. Световые вспышки фиксируются фотоумножителем, который превращает их в электрические импульсы. Амплитуда этих импульсов пропорциональна интенсивности вспышек, а следовательно, энергии излучения, вызывающего эти вспышки.
Большинство жидких сцинтилляторов, применяемых в настоящее время, приготовлено на основе толуола или диоксана. Толуоловые сцинтилляторы имеют более высокую эффективность регистрации низкоэнергетического бета-излучения. Однако водные образцы в толуоловых сцинтилляторах измерять неудобно из-за малой растворимости воды в толуоле и сильного тушения сцинтилляторов, которое вызвано введением воды.
В качестве растворителя в сцинтилляционных смесях, предназначенных для измерения водных образцов, чаще применяют диоксан. В диоксане можно растворить большое количество воды (до 30%).
Основными компонентами любого сцинтилляционного счетчика являются сцинтиллятор, фотоумножитель, логарифмический усилитель электрических импульсов, электронная система анализа и регистрация (рис. 1).
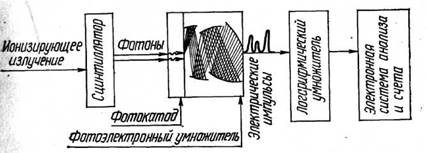
Рис. 1. Принцип устройства сцинтилляционного датчика
С целью исключения импульсов, соответствующих фону фотоумножителей, сцинтилляции детектируются не одним, а двумя фотоумножителями, соединенными в электронной схеме совпадения, что позволяет почти полностью исключить импульсы, соответствующие фону ФЭУ.
Основные источники фона сцинтилляционных счетчиков.
1. Внешнее излучение (космическое и излучение от источников в помещении лаборатории). Внешний фон в значительной степени ослабляется защитой и дискриминацией импульсов с большой амплитудой.
2. Внутреннее излучение, обусловленное загрязненностью радиоактивными изотопами материалов защиты с самого счетчика, а также присутствием в воздухе эманации радия и тория.
3. Случайные совпадения между двумя ФЭУ оптической обратной связи (свечение остаточных газов, люминесценция стекла колб ФЭУ или динодов).
4. Случайные совпадения из-за термошумов ФЭУ и конечного разрешающего времени схемы совпадений.
Для уменьшения фона используют материалы, содержащие минимальное количество радиоактивных изотопов.
Для каждого изотопа характерно непрерывное распределение энергии спектра, максимум которого является специфической характеристикой данного изотопа. Современные сцинтилляционные счетчики настроены таким образом, чтобы фиксировать импульсы в узком диапазоне амплитуд. Это позволяет уменьшить влияние других изотопов и фонового излучения на определение активности нужного изотопа путем амплитудного анализа.
При установке окна счетчика таким образом, чтобы регистрировались только импульсы, энергия которых лежит в интервале х—у, будут просчитываться основная часть излучения изотопа А и незначительная часть излучения изотопа Б.
Определение гамма-излучения — более простая операция, чем определение бета-излучения методом жидкостной сцинтилляции. Оно не требует подготовки образцов, что позволяет экономить время и реактивы, а также сокращается время измерения за счет более высокой удельной их активности, чем бета-радиоактивных изотопов.
Современные гамма-счетчики рассчитаны для обработки и анализа результатов радиометрии большого количества образцов в автоматическом режиме. Широкое внедрение в практику радиоиммунологического анализа привело к создании» поколения специализированных для РИА гамма-счетчиковсреди которых можно отметить RIA GAMMA (LKB — Швеция), «Гамма-2» и «Гамма-12» (СССР). Эти радиометры предназначены для регистрации гамма-излучения 125 J, 131 J, 57 Сг, 51 Со и др.
Счетчики RIA GAMMA снабжены системой автоматической подачи в детектор и смены образцов. С помощью пульта управления программируют время счета, число параллельных проб, высоту подачи в детектор образцов, последовательность калибровочных проб и концентрации стандартов, параметр построения счетчиком калибровочной кривой. По желанию оператора самописец может регистрировать на перфоленте последовательность проб, характер проб, концентрации стандартов, время счета образцов, число импульсов за время измерения, число импульсов в минуту, среднее значение между параллельными пробами, ошибки измерения радиоактивности, значения концентраций неизвестных образцов и некоторые другие данные. Построение калибровочной кривой и обработка результатов осуществляются с помощью встроенного в счетчик микрокомпьютера, память которого хранит до 64 килобит информации.
Радиометр «Гамма-12» предназначен для одновременного счета и обработки 12 образцов за счет наличия в нем 12 детекторов. Это самый высокопроизводительный гамма-счетчик, за один рабочий день можно просчитать до 6000 образцов, но смену проб необходимо производить вручную.
Данные счетчики — приборы многоцелевого назначения. Кроме обработки данных РИА, они пригодны для радиометрии любых других гамма-активных изотопов в оптимальном диапазоне энергии гамма-квантов от 10 до 999 кэВ.
Радиометры «Rack-Beta» и «Бета-2», предназначенные для регистрации бета-частиц, имеют аналогичный принцип устройства и работы. Управление счетчиком осуществляется посредством программирования всех необходимых параметров счета и обработки результатов. По желанию оператора самописец регистрирует номер образца по порядку, характер пробы, время счета, число импульсов в заданное время, число импульсов в минуту, число распадов в минуту, ошибку измерения, среднее значение между двумя измерениями, поправку на тушение, хемилюминесценцию. Все эти параметры обрабатывают и регистрируют по каждому из каналов. Счет изотопов по каждому из каналов осуществляется одновременно. Счетчики рассчитаны для радиометрии практически всех бета-излучателей и способны обрабатывать результаты РИА в случае использования в качестве метни 14 С или 3 Н.
Индивидуальный дозиметрический контроль заключается в систематическом измерении дозы, получаемой отдельными лицами за определенный промежуток времени (за день, неделю и т. д.). Осуществляют этот контроль с помощью небольших приборов карманного типа — индивидуальных дозиметров (фотодозиметры ИФК, люминесцентные дозиметры ИЛК, дозиметры конденсаторного типа ИДК).
Дозиметрический фотоконтроль — наиболее распространенный метод дозиметрии. Он основан на свойстве ионизирующего излучения создавать скрытое изображение в фотоэмульсии, которое после проявления и фиксации приводит к почернению пленки. Степень ее почернения пропорциональна дозе излучения. ИФК применяют для дозиметрии рентгеновского и гамма-излучения с энергией от 0,1 до 3 МэВ, бета-излучений— 1 и выше, тепловых нейтронов — от 0,05 до 2 МэВ.
В зависимости от дозы излучения используют различной чувствительности пленки («Рентген X», «Рентген XX», РМ-5-1, РМ-5-3 и др.). В комплект дозиметра ИФК входят кассеты для пленок, кювета для проявления, промывки и фиксирования пленок, рамки для размещения пленок при проявлении, промывке и фиксировании, а также денситометр для измерения оптической плотности почернения пленок.
Методика индивидуального дозиметрического фотоконтроля основана на сравнении оптической плотности почернения фото-пленок ИФК с контрольными, которые облучены известной дозой гамма-излучения. Следовательно, в ИФК в качестве детектора используется дозиметрическая фотопленка, вставленная в светонепроницаемую кассету. Для устранения зависимости плотности почернения пленки от энергии рентгеновского или гамма-излучения в кассете имеются встроенные фильтры из алюминия и свинца. Кассету помещают в чехол из пластика, который пристегивают к одежде. Ниже описана техника дозиметрии при работе с дозиметром ИФКУ-1 (рис. 7).
Индивидуальный контроль доз рентгеновского и гамма-излучения проводят с помощью небольших металлических или пластмассовых ионизационных камер. Принцип действия дозиметров основан на измерении потенциала собирающего электрода камеры, который пропорционален дозе облучения. Для индивидуального контроля используют прямопоказывающие (ДК-0,2; ДП-22-В; ДП-24) и непрямопоказывающие (КИД-1; КИД-2 и др.) дозиметры.
Индивидуальный дозиметр ДК-0,2 предназначен для измерения доз рентгеновского и гамма-излучения в пределах 10—200 мР в диапазоне энергий 150 кэВ—2 МэВ. Шкала прибора имеет 20 делений. Погрешность измерений доз во всем диапазоне не превышает 10%.
Карманными дозиметрами ДП-22-В и ДП-24 измеряют индивидуальные дозы гамма-излучения в диапазоне 2—50 Р при мощности дозы 0,5—200 Р/ч в диапазоне энергий излучения 0,2— 2 МэВ. Погрешность измерений дозы не превышает 10% максимального значения шкалы. Принцип действия, конструкция и комплектация дозиметров аналогичны дозиметру ДК-0,2.
Внешне дозиметры ДК-0,2, ДП-22-В и ДП-24 напоминают авторучку. Внутри корпуса смонтированы: подвижная система электрометра с держателем, закрепленная в изоляторе, микроскоп, состоящий из объектива, оправы объектива с диафрагмой, отсчетной шкалы и окуляра. Подача начального потенциала на электрометр осуществляется через подвижной контакт, закрепленный в эластичной мембране. Для предохранения от загрязнений нижний торец дозиметра закрыт колпачком, который имеет прозрачное дно и открывается только на время зарядки дозиметра. На корпусе дозиметра имеется держатель для крепления его к одежде.
Ионизационной камерой является объем, в котором размещена подвижная система электрометра, ее держатель выполняет роль собирающего электрода ионизационной камеры. Ионизационный объем ограничен корпусом ионизационной камеры, спрессованной из проводящей воздухоэквивалентной пластмассы. Зарядное устройство дозиметров выполнено в виде пульта. Пульт имеет корпус, зарядное гнездо, потенциометр для установки необходимого напряжения, переключатель и лампочку для подсветки. Дозиметры состоят из малой ионизационной камеры и портативного электрометра. Перед началом работы электрометр заряжается до такого потенциала, при котором нить электрометра устанавливается на нулевое деление шкалы. Под действием рентгеновского или гамма-излучения в камере возникает ионизационный ток, разряжающий электрическую емкость прибора, и потенциал электрометра уменьшается пропорционально дозе облучения. Шкала прибора отградуирована в миллирентгенах.
24. Действие радиоактивных излучений на клетки
Рассмотрим основные закономерности биологического действия йонизирущего излучения. Эти закономерности было установлено на основе действия однородного за составом излучения (например, гамма- альфа-излучения) на однородные группы биологических объектов (одноклеточных организмов или клеток в культуре, сухого семени растений или линейных мышей одной пола и одного возраста). Лишь такие исследования групп организмов дали возможность в чистом виде установить фундаментальные закономерности биологического действия йонизирующего излучения. К этим закономерностям належат: 1) формы кривых выживаемости и их связь с генетической структурой организмов; 2) зависимость действия излучения от мощности его дозы и фракционирования облучения; 3) зависимость эффекта облучения от линейной передачи (потери) энергии (ЛПЕ), обусловленной прохождением излучения сквозь вещество. Знания этих закономерностей поможет понять те особенности биологического действия излучения, которые наблюдаются в случае загрязнения радионуклидами естественных территорий.
Основой радиобиологии являются закономерности действия йонизирующего излучения на разные биологические объекты (микроорганизмы, растения, животного) и на человека. С точки зрения радиоэкологии особый интерес составляют три особенности такого действия. Во-первых, это хроническое влияние излучения, главным образом низких мощностей; во-вторых, объединения внешнего и внутреннего (за счет радионуклидов, которые содержатся внутри клеток и организмов) облучения; в-третьих, одновременное облучение биологических объектов излучением с разными физическими характеристиками (в основном с разной ЛПЕ). Чтобы продемонстрировать, как эти три особенности облучения влияют на его эффект, рассмотрим основные закономерности биологического действия острого (относительно кратковременного) одноразового внешнего облучения биологических объектов гамма-излучением 60 Со или 137 Сs (из ЛПЕ около 0,1 кев/мкм).
Различают три типа такого действия: 1) гибель клеток в процессе деления; 2) раннюю пекиотичную дегенерацию озаренных клеток; 3) возникновения мутаций.
Существует понятия радиочувствительность клеток к облучению. Клетки разных организмов, а также разных органов проявляют разную чувствительность (зависит от дозы облучения) к облучению. Это характеризуется индивидуальной чувствительностью организмов. Пораженность клеток может быть на разных стадиях развития или размножения организма (клетки). Довольно часто наблюдается пораженность клеток в стадии интерфазы.
Интерфазною называют гибель озаренных клеток без предыдущего деления, точнее к фазе митоза. Различают две формы такой гибели: а) раннюю пекнотичную дегенерацию; б) позднюю интерфазную гибель.
Ранняя пикнотическая дегенерация происходит вскоре после облучения и оказывается в быстрому пикнозе клеточного ядра (его сжимании), а потом его распаде на фрагменты.
Поздняя интерфазная гибель присущий клеткам, которые не способные вступить в фазу митоза ли утратили эту способность (вследствие облучения большими дозами), долго остаются живыми и гибнут "естественной смертью", без пекнотичной дегенерации ядер.
Ранняя пекнотичная дегенерация ядер не наблюдается у одноклеточных организмов, у клеток высших растений или животных в культуре, непролиферующих клеток дифференцированных органов и тканей, а также в малодиференцированных, что активно размножаются, клеток высших организмов.
Интерфазная гибель присущий клеткам животных, которые дифференцируются (а возможно, и растений), независимо от того, делятся они или нет. Это клетки эмбриональных тканей млекопитающих и птиц во время органогенеза; клетки костного мозга и кишок, которые после дифференциации компенсируют физиологическое уменьшение клеточной массы путем перемещения зрелых клеток в кровяное русло или ворсинки и крипты кишок; некоторые клетки периферической крови, прежде всего лимфоциты. Малодифицированые, стволовые, клетки кроветворных органов и ворсинок кишок, а также високодиференцированы, но способные к размножения клетки разных органов (например, печени, роговицы глазу) гибнут, как и одноклеточные, в процессе одного или нескольких делений.
Для интерфазной гибели животных клеток характерный, таким образом, состояние, связанное с процессом дифференциации. Если вывести озаренные клетки из такого состояния, интерфазная гибель прекратится и клетки будут гибнуть лишь в процессе деления. Это наблюдается в случае наложения лигатуры на селезенку озаренного животного (что резко уменьшает его кровоснабжение) ли при перенесении в условия культуры кусочков мозга куриного эмбриона, который развивается (это прекращает дальнейшую дифференциацию клеток). В условиях продолжения дифференциации интерфазная гибель клеток наступает через определенное время и охватывает тем большую часть популяции, чем большей была поглощенная доза ионизирующего излучения. Дозы, которые причинят интерфазную гибель 50 % способных к ней клеток млекопитающих, составляют, как правило, 1,0-1 ,5 Гр.
У млекопитающих интерфазная гибель отвечает в основном за раннее послерадиационное опустошения костного мозга и других кроветворных органов. За устранение следствий этого опустошения отвечают те стволовые клетки, которые остаются живыми после облучения и не гибнут в процессе деления.
Характер кривых доза - эффект, а также зависимость интерфазной гибели от мощности дозы и линейной передачи энергии (ЛІТЕ) излучения не исследованы. Относительно инкорпорированных радионуклидов, то можно считать, что закономерности их действия на интерфазную гибель клеток приблизительно такие самые, как в случае хронического внешнего облучения.
Действие йонтзируючого излучения на многоклеточные организмы
Повышение надежности геному - основной, но далеко не единый способ защиты организмов от разных поражающих влияний. Так, много простейших, оставаясь одноклеточными, использовали, вероятно, другой способ повышения своей надежности - многоразовое дублирование молекул ДНК, благодаря чему в них не столько увеличилось значения D0, сколько возросло плечо кривой выживаемости, которая наблюдается даже в малохромосомних амеб. Многоклеточные животные и в особенности растения обеспечивают надежность своего организма благодаря способности к регенерации, очень развитое в низших бесхребетных и во всех без исключения растений. Большое количество клеток меристемы, которые находятся в состоянии покоя, способное пробуждаться и давать новые побеги (в случае повреждения уже существующих), что делает высшие растения очень стойкими к внешнему действию излучения.
Установлено, что при облучении многоклеточных организмов, как растений, так и животных, их радиочуствительность предопределяется тремя факторами: 1) радиочуствительность клеток критических органов (например, точек роста у растений, столбових клеток костного мозга или кишок у животных); 2) количеством таких клеток в организме; 3) критическим количеством этих клеток, способной обеспечить репонуляцию органа после гибели большинства его клеток вследствие облучения.
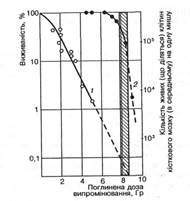
Мал. 1. Кривые выживаемости столбовых клеток костного мозга мышей (1) и взрослых мышей этой линии (2) после действия гамма-излучения 60Со (заштрихован интервал доз, которая отвечает 50-10 % выживаемости животных) (за М.В. Тимофєєвим-Ресовським и др., 1968)
В качестве примера на рис. 1 изображен кривые выживаемости мышей и столбовых клеток костного мозга мышей этой самой линии. По этому графику можно определить, что за поглощенной дозы излучения 8 Гр (800 советов) гибнет 50 % этих животных и 99,8 % их столбовых клеток. Поскольку за этой дозы мыши гибнут только вследствие нарушения кровообразования, можно сделать вывод, который критическим для их выздоровления от лучевой болезни будет сохранение в них жизнеспособными 0,2 % столбовых клеток, которая отвечает приблизительно 100 таким клеткам на организм одной мыши. И действительно, если у таких мышей перед облучением в абсолютно летальной дозе так заэкранировать свинцовой полоской одну из них, чтобы остались неповрежденными приблизительно 100 столбовых клеток, сразу же после облучения ввести изологический костный мозг в количестве, которое содержит близко 100 столбовых клеток, все животные останутся живыми. При этом можно убедиться, что радиочувствительность и жизнеспособность самых столбовых клеток не зависят от того, облучают их вне организма ли в организме мышей и пересаживают облученным или необлученным животным. Этот пример ярко свидетельствует, что жизнеспособность млекопитающих при частично летальных поглощенных дозах излучения определяется только степенью поражения их столбовых клеток вследствие прямого действия на них ионизирующего излучения. Рассмотренный выше пример с мышами можно перенести на любое многоклеточное животного и, что в особенности важно, на человека.
Общее количество столбовых клеток, которые содержатся в организме, а также минимальное количество их, достаточное для обеспечения выживаемости облученного животного, есть характеристиками вида, хотя и поддаются излиянию экспериментатора.
Список литературы
1. Дертингер Д., Юнг К. Молекулярная радиобиология. — М.: Атомішдлі, 1973. - 248 с.
2. Практикум по ветеринарной радиобиологии / Под ред. А.Д. Белова. – М.: Агропромиздат, 1988. – 240 с.
3. Сельскохозяйственная радиоэкология / Под ред. Р.М. Алексахина. — М.: Наука, 1993. - 538 с.
4. Циммер К. Проблемы количественной радиобиологии. — М.: Госатомиздат, 1962. - 100 с.