| Скачать .docx | Скачать .pdf |
Дипломная работа: Антиоксидантная система при внутриутробной гипоксии плода
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
1.1. Этиология, патогенез и клиника плацентарной недостаточности.
Хроническая внутриутробная гипоксия плода
Плацентарная недостаточность (ПН) – одна из важнейших проблем акушерства, неонатологии и перинатологии. Она является причиной внутриутробной гипоксии, задержки роста и развития плода, его травм в процессе родов.
ПН приводит к увеличению перинатальной смертности, 20% случаев перинатальной смертности непосредственно связаны с патологией плаценты. ПН обуславливает высокую частоту соматической и инфекционной заболеваемости новорожденных, служит причиной нарушений физического и умственного развития ребенка.
В соответствии с основными положениями адаптационно-регуляторной теории при развитии ПН на начальных этапах воздействия неблагоприятного фактора прогрессирование заболевания характеризуется фазой устойчивой гиперфункции. По мере истощения адаптационных механизмов - при длительном влиянии неблагоприятных факторов - развивается фаза декомпенсации [4, 5, 38].
Выделяют первичную и вторичную ПН.
Первичная ПН развивается в сроки формирования плаценты (до 16-ой недели беременности) и с наибольшей частотой встречается у женщин, страдающих привычным невынашиванием, а также у беременных с бесплодием в анамнезе.
Вторичная ПН, как правило, возникает после завершения процессов формирования плаценты и обусловлена экзогенными влияниями, прежде всего - перенесенными во время беременности заболеваниями. Течение как первичной, так и вторичной ПН может быть острым и хроническим.
Доказано, что при физиологически протекающей беременности плацентарные сосуды находятся в состоянии дилатации и не реагируют на сокращающие стимулы. Это обстоятельство обеспечивает равномерное поступление кислорода и питательных веществ к плоду. Рефрактерность сосудов плаценты и системы кровообращения матери к вазопрессорам обеспечивается за счет возрастающей продукции эндотелиальных факторов релаксации - простациклина и оксида азота (II). Синергичное действие этих факторов служит основным условием адаптации материнских сосудов к увеличению нагрузки на кровоток, обеспечивает системную вазодилатацию и снижение артериального давления по мере прогрессирования беременности [5, 7].
Патология плацентарного кровообращения развивается в тех случаях, когда инвазивная способность трофобласта снижена или процесс инвазии охватывает спиральные сосуды неравномерно. При этом в сформировавшихся плацентарных сосудах частично сохраняется гладкомышечная структура, адренергическая иннервация, и, следовательно - способность реагировать на вазоактивные стимулы. Таким образом, участки плацентарных сосудов, сохранившие эндотелиальные и гладкомышечные элементы, становятся мишенью для действия медиаторов, циркулирующих в кровотоке. Структурные изменения, происходящие в сосудах в ответ на их расслабление и сокращение, лежат в основе нарушений плацентарного кровообращения [26].
Интенсивность маточно-плацентарного кровотока служит основным фактором, определяющим поступление кислорода к плоду. При недостаточном снабжении плацентарной ткани оксигенированной кровью в трофобласте нарушается течение метаболических процессов. В условиях, когда кровь, омывающая межворсинковое пространство, недостаточно насыщена кислородом, трофобласт компенсирует собственные метаболические потребности за счет увеличения площади капиллярной сети плодовой части плаценты. Если способность плаценты к развитию коллатерального кровообращения не удовлетворяет полностью потребностям плода, то в недостаточно кровоснабжаемых участках плацентарной ткани развиваются выраженные нарушения микроциркуляции и локальные ишемические изменения. При повреждении 1/3 маточно-плацентарных сосудов компенсаторные возможности плодовой части плаценты обычно не могут полностью обеспечить возрастающие энергетические потребности растущего плода. Нарушается плацентарная перфузия, создаются условия для отставания темпов роста и развития плода [4, 5, 7].
Недостаточное поступление кислорода в межворсинковое пространство оказывает повреждающее воздействие на эндотелий сосудов ворсинчатого трофобласта, где индуцируются процессы свободнорадикального окисления. Усиленная васкуляризация фетоплацентарной ткани, которая происходит в условиях недостаточного поступления кислорода и дефицита продукции эндотелиальных факторов релаксации под влиянием кислородных свободных радикалов приводит к истощению энергетических резервов клеток и нарушению структуры сосудов. По мере истощения запасов АТФ, сосудистые клетки реализуют свои энергетические потребности за счет процессов анаэробного гликолиза. Эндогенные источники энергии (АДФ, аденозин) нуждаются в усиленном притоке Са2+ в цитозоль клеток из внутриклеточных депо. Увеличение концентрации Са2+ в цитозоле клеток приводит к высвобождению мощнейшего эндогенного вазоконстриктора - эндотелина. Увеличение продукции О2- в эндотелии происходит в период перехода от ишемии к реперфузии, провоцирует высвобождение эндотелина и вазоспазм [9].
Таким образом, недостаточное кровоснабжение трофобласта служит основным фактором, приводящим к нарушению регуляции кровообращения в плаценте. Перепадам давления в плацентарных сосудах вследствие ишемии-реперфузии принадлежит центральная роль в патогенезе ишемических повреждений плацентарной ткани и жизненно важных органов плода.
К факторам риска развития ПН относят влияние природных и социально-экономических условий, стрессовых ситуаций, тяжелых физических нагрузок, употребление алкоголя, курение, различные токсикомании, возраст, конституциональные особенности будущей матери, экстрагенитальные заболевания, отягощенный репродуктивный и акушерско-гинекологический анамнез, особенности течения данной беременности.
Основной причиной гипоксии плода и рождения детей с нарушением мозгового кровообращения является ПН. Поэтому выбор оптимальных сроков и способа родоразрешения женщин с данной патологией позволяет существенно снизить перинатальные потери [4, 7, 13].
Хроническая внутриутробная гипоксия плода (ХВГП), нарушение маточно-плацентарного и плодово-плацентарного кровотока, показателей биофизического профиля плода служат причиной снижения компенсаторно-приспособительных реакций плода и развития тяжелых перинатальных повреждений мозга в процессе родов. Нарушения функциональных связей в системе мать-плацента-плод, характерные для ПН, способствуют развитию патологии сократительной деятельности матки в родах (патологического прелиминарного периода, несвоевременного излития околоплодных вод, слабости и дискоординированной родовой деятельности). Быстрый и стремительный темп родов также неблагоприятен для плода, развивающегося в условиях длительной гипоксии. Поэтому при составлении плана ведения родов важно иметь, по-возможности, более полную информацию о состоянии плацентарного кровотока и способности плода к компенсаторным реакциям [36].
ХВГП обусловлена уменьшением или прекращением поступления в организм кислорода.
В патогенезе ХВГП основным фактором является фетоплацентарная недостаточность при акушерской и экстрагенитальной патологии. Нарушения структуры плаценты и процессов микроциркуляции в ней при поздних гестозах беременности, анемиях, экстрагенитальных заболеваниях приводят к хроническому кислородному голоданию плода. В результате происходит нарушение функции сердечно-сосудистой и центральной нервной систем, регуляции гомеостаза, снижение иммунологической реактивности организма плода [1, 4, 5, 13].
Гипоксические состояния связаны с изменениями в сложной системе мать-плацента-плод. Это свидетельствует о том, что исход беременности для плода и во многом для матери зависит от состояния компенсаторно-приспособительных механизмов фетоплацентарного комплекса и рациональной коррекции выявленных нарушений.
Основные проявления гипоксии плода: нарушение частоты сердечных сокращений, ухудшение звучности сердечных тонов; появление аритмии, снижение интенсивности движения плода, изменение показателей кислотно-основного равновесия. Последствиями перинатальной гипоксии могут быть различные патологические состояния организма ребенка: кардиопатии, пороки сердца, детский церебральный паралич и др. [4, 5, 7, 13].
1.2. Гормоны плаценты при физиологически протекающей беременности и при хронической внутриутробной гипоксии плода
Фетоплацентарный комплекс играет важную роль в развитии и поддержании беременности и синтезирует ряд местных и гуморальных регуляторов, в том числе и гормональной природы. К гормонам беременности относятся: стероидные гормоны (прогестерон, эстрогены, кортизол), хорионический гонадотропин (ХГЧ), плацентарный лактоген (ПЛ), хорионический тиреотропный гормон (ХТТГ), хорионический адренокортикотропный гормон (ХАКТГ), релаксин, пролактин, кортикотропин-рилизинг-фактор (кортиколиберин, КТРФ), гонадотропин-рилизинг-гормон (ГТ-Рг), тиреотропин-рилизинг-фактор (тиролиберин), соматостатин, альфа-меланоцитстимулирующий гормон (α-МСГ), бета-липотропин, эндорфины, энкефалины и т.д.
Прогестерон (ПГ) - стероидный гормон желтого тела яичников и плаценты, необходимый для всех стадий беременности.
ПГ образуется в яичниках и в небольшом количестве в коре надпочечников под влиянием лютеотропного гормона. Метаболизируется большей частью в печени. Во время беременности синтез ПГ стимулируется ХГЧ. В 1 триместре беременности образование ПГ происходит в организме матери; со 2 триместра первые этапы синтеза происходят в организме матери, дальнейшие этапы осуществляются плацентой. ПГ подготавливает эндометрий матки к имплантации оплодотворенной яйцеклетки, а затем способствует сохранению беременности: подавляет активность гладкой мускулатуры матки, поддерживает в центральной нервной системе доминанту беременности; стимулирует развитие концевых секреторных отделов молочных желез и рост матки, синтез стероидных гормонов; оказывает иммунодепрессивное действие, подавляя реакцию отторжения плодного яйца. Для проявления ПГ своего физиологического эффекта в женском организме требуется предварительное воздействие эстрогенов. Главным органом-мишенью ПГ является матка. Гормон вызывает секреторную трансформацию пролиферативно-утолщенного эндометрия, тем самым обеспечивая его готовность к имплантации оплодотворенной яйцеклетки. Вне беременности секреция ПГ начинает возрастать в предовуляторном периоде, достигая максимума в середине лютеиновой фазы. Прогестерон вызывает стимуляцию теплового центра и повышение температуры на 0,50 С после овуляции в лютеиновую фазу менструального цикла. Концентрация его возвращается к исходному уровню в конце цикла. Данное резкое падение концентрации ПГ вызывает менструальное кровотечение. Определение уровня ПГ используют для оценки адекватности лютеальной фазы и контроля эффективности овуляции. Содержание ПГ в крови беременной женщины увеличивается, повышаясь в 2 раза к 7-8 неделе, а затем более плавно возрастает к 37-38-й неделям [8, 20, 32].
Еще один важнейший гормон, который наряду с ПГ, оказывает приоритетное влияние на деятельность женской половой системы – эстроген.
Эти стероидные гормоны вырабатываются фолликулярным аппаратом женщин. В небольшом количестве гормон вырабатывается корой надпочечников, но его количества незначительны в сравнении с долей, производимой яичниками. Продукция их находится в прямой зависимости от состояния маточно-плацентарного кровообращения и наличия предшественников, вырабатываемых в организме матери и плода.
У женщин в физиологических концентрациях эстрогены вызывают рост и дифференцировку клеток эпителия влагалища, способствуют развитию вторичных половых признаков, подготавливают репродуктивную систему к беременности, обеспечивают вход яйцеклетки в половые пути и возможность ее оплодотворения после овуляции. Сохранение рН среды влагалища, ритмические сокращения матки, развитие молочных желез, распределение подкожного жира, характерное для женского типа, появление либидо – все эти эффекты обеспечивают в том числе и эстрогены. Они же способствуют регулярному отторжению эндометрия и регулярным кровотечениям.
Эстрогены «работают» в паре с ПГ, в противовес друг другу. Нарушение этого равновесия приводит к ряду тяжелейших заболеваний. Эстрогены в высокой концентрации вызывают гиперплазию эндометрия и его кистозно-железистое перерождение [20, 32, 48].
Кроме стероидных гормонов в крови матери находятся также пептидные гормоны. Они, попадая в кровь матери и плода, вызывают изменения в метаболизме, иммунных процессах, участвуют в регуляции маточно- и фетоплацентарного кровотока.
Для развития беременности важен плацентарный гормон – хорионический гонадотропин. ХГЧ представляет собой гликопротеин, синтезируемый клетками синцитиотрофобласта плаценты. ХГЧ является гликопротеином-димером. Состоит из двух субъединиц: альфа и бета. Альфа-субъединица идентична с альфа-субъединицами гормонов гипофиза: тиреотропным гормоном (ТТГ), фолликулстимулирующим гормоном (ФСГ) и лютеинизирующим гормоном (ЛГ). Концентрация бета-ХГЧ в моче достигает диагностического уровня на 1-2 дня позже, чем в сыворотке крови.
В первом триместре беременности ХГЧ обеспечивает синтез ПГ и эстрогенов, необходимых для поддержания беременности, желтым телом яичника. ХГЧ действует на желтое тело подобно лютеинизирующему гормону, т.е. поддерживает его существование. Это происходит до тех пор, пока комплекс плод-плацента не приобретет способность самостоятельно формировать необходимый гормональный фон. Действуя на плаценту, ХГЧ стимулирует выработку эстриола и прогестерона. У плода мужского пола ХГЧ стимулирует клетки Лейдига, синтезирующие тестостерон, необходимый для формирования половых органов по мужскому типу.
Синтез ХГЧ осуществляется клетками трофобласта, после имплантации эмбриона (с 6-8 дня после оплодотворения яйцеклетки) и продолжается в течение всей беременности. При нормальном течении беременности, в первые недели содержание бета-ХГЧ удваивается каждые 2 дня. Пик концентрации ХГЧ приходится на 10-11 неделю беременности, затем его концентрация начинает медленно снижаться. При многоплодной беременности содержание ХГЧ увеличивается пропорционально числу плодов. Пониженные концентрации ХГЧ могут говорить об эктопической беременности или угрожающем аборте.
Пролактин (Прл) известен как важный полифункциональный гормон гипофиза, большинство биологических эффектов которого связано с репродуктивной функцией.
Прл, в основном, синтезируется в гипофизе и после ряда событий посттрансляционного процессинга секретируется лактотрофами передней доли гипофиза. По структуре и биологическим свойствам пролактин имеет общие черты с гипофизарным гормоном роста ( соматотропином), плацентарным лактогеном и пролиферином и объединен с ними в отдельное семейство - семейство пролактинподобных белков.
Известно, что опиоидные пептиды и, в особенности, продукт процессинга проопиомеланокортина (ПОМК) - бета-эндорфин входят в число факторов, стимулирующих синтез препролактина - предшественника пролактина. С другой стороны имеются данные, что еще один продукт процессинга ПОМК - альфа-МСГ ингибирует секрецию Прл.
Большинство биологических эффектов пролактина связано с репродуктивной функцией: он вызывает лактацию у млекопитающих, пролиферацию зобной железы у птиц, поддерживает активность желтого тела и продукцию прогестерона, действует на рост и дифференцировку тканей. Кроме этого пролактин влияет на водносолевой обмен, обладает анаболическим действием, вызывает ряд поведенческих реакций у млекопитающих, земноводных и птиц.
В большом количестве при участии надпочечников и печени плода фетоплацентарный комплекс продуцирует кортизол (Кр). Кр - глюкокортикоид, синтезируемый в коре надпочечников. Секреция кортизола подчиняется суточному ритму: у детей в отсутствие стресса концентрация кортизола в сыворотке в 8:00 составляет обычно 11± 2,5мкг%, а в 23:00 - 3,5 ± 0,15 мкг%. Суточный ритм секреции кортизола устанавливается к концу первого года жизни, поэтому у грудных детей он проявляется не столь четко. Этот гормон играет важную роль в развитии альвеолярного эпителия и секреции сурфактанта, которые помогают расправлению легких при первом вздохе ребенка [8, 13].
Плацентарный кортикотропин-рилизинг-фактор вырабатывается трофобластом, хорионом, амнионом и децидуальной тканью и обнаружен в крови плода. Кроме того он синтезируется также гипофизом. Инкубация плацентарной ткани человека с КТРФ приводит к дозозависимой секреции эндорфина и меланоцитстимулирующего гормона. Рецепторы КТРФ были обнаружены в миометрии, где КТРФ оказывает констрикторный эффект, действуя синергично с окситоцином. КТРФ стимулирует также синтез NO эндотелием сосудов плаценты, что приводит к дилатации этих сосудов и улучшению фетоплацентарного кровообращения [8].
Таким образом, вырабатываемый во время беременности плацентарный КТРФ участвует в развитии гиперкортицизма у матери, обеспечении адекватного кровоснабжения плода (возможно, за счет активации NO-синтазы в стенке сосудов фетоплацентарной системы) и затем, непосредственно перед родами, в усилении сократимости матки.
Таким образом, гормонопродуцирующая функция плаценты определяет физиологические процессы в системе мать-плацента-плод. Однако, кроме участия в развитии и поддержании беременности плацентарные гормоны могут быть вовлечены в патогенез нарушений состояния фетоплацентарного комплекса.
1.3. Ферменты плаценты при физиологическом течении беременности и при хронической внутриутробной гипоксии плода
В снабжении плода питательными веществами и продуктами обмена важную роль играют ферменты плаценты, которые локализуются в основном внутриклеточно. Среди них следует выделить группу дыхательных ферментов: оксидазы, каталаза, НАД - и НАДФ-диафоразы, дегидрогеназы (ДГ).
К ферментам плаценты, участвующим в углеводном обмене, относят диастазу, инвертазу, лактазу, карбоксилазу, кокарбоксилазу и др. Активность их в плаценте в 4-8 раз выше, чем в печени матери, и повышается по мере развития беременности и увеличения потребностей плода [16,28].
В плацентарном цито- и синцитиотрофобласте обнаружена аминопептидаза А (АП А, ангиотензиназа). Фермент осуществляет превращение ангиотензина II в ангиотензин III. По мере развития беременности в сыворотке крови матери наблюдается повышение активности АП А. Предполагается участие ангиотензиназы в снижении прессорного ответа сосудов на ангиотензин II при ХВГП [28].
Важную роль в поддержании и развитии беременности играет цистинаминопептидаза (ЦАП), наибольшая активность которой обнаружена в лизосомальной фракции плацентарной ткани. Предполагается ее участие в деградации ангиотензина II, благодаря чему ЦАП может вовлекаться в поддержание кровяного давления у матери на нормальном уровне в течение беременности [11].
В регуляцию иммуных процессов во время беременности вовлечена плацентарная аминопептидаза N (АП N). Она участвует в деградации иммуномодулирующих пептидов. Кроме того, АП N гидролизует энкефалины, соматостатин, нейрокинин А, а также лиз-брадикинин, ангиотензин III [8].
Таким образом, большинство аминопептидаз участвует в обмене вазоактивных пептидов. Вероятно, эти ферменты препятствуют сужению плацентарных сосудов и вовлекаются в перераспределение фето-плацентарного кровотока при ХВГП.
В микроворсинках плацентарного синцитиотрофобласта в большом количестве содержится ангиотензинпревращающий фермент – компонент ренин-ангиотензиновой системы (РАС). Фермент катализирует превращение ангиотензина I в ангиотензин II, участвует в деградации брадикинина. Показано, что в норме содержание фермента в плазме крови беременных постоянно нарастает к III триместру [16].
Также в микроворсинках плаценты человека обнаружена карбоксипептидаза N. Фермент, являясь компонентом калликреин-кининовой системы (ККС), главным образом контролирует циркуляцию крови в фетоплацентарном комплексе, участвует в деградации брадикинина в плаценте и сыворотке крови. Обнаружено, что уровни брадикинина в артериальной и венозной крови сосудов пуповины ниже, чем в крови матери [38].
Многообразные функции в плацентарной ткани выполняют пептидгидролазы. Определенную роль в развитии беременности, особенно в ранние сроки, в период имплантации плодного яйца, играют катепсины, активность которых прогрессивно снижается в процессе развития беременности, особенно при перенашивании.
Таким образом, при осложнениях беременности отмечаются изменения в функционировании ферментных систем плаценты, в том числе тех, которые участвуют в образовании и инактивации пептидов, регулирующих кровоток в ФПК. Последние, в свою очередь, могут быть вовлечены в развитие многочисленных адаптационных реакций. Поэтому представляется важным исследование активности ферментов обмена биологических активных пептидов при патологиях беременности.
1.3.1. Катепсины
Катепсины - (от греч. kathepso-перевариваю), ферменты класса гидролаз, катализирующие гидролизпептидной связи. Содержатся в тканях животных и человека. Неспецифический протеолиз играет важную роль в регуляции белкового обмена, в ходе которого белки организма постоянно обновляются.
По строению активного центра различают три основных группы катепсинов. В группу катепсинов, содержащих в активном центре остаток серина (так называемые сериновые амидгидролазы), входят катепсин А (сериновая карбоксипептидаза A1 )и катепсин G. Обширную группу составляют катепсины, содержащие в активном центре цистеин (тиоловые амидгидролазы). В эту группу входят катепсины В, С, Н, L, N и S. К катепсинам, содержащим в активном центре остаток аспарагиновой кислоты (так называемые карбоксильные амидгидролазы), относятся катепсин D и катепсин Е. Катепсин С обладает также сильно выраженной транспептидазной активностью - катализирует перенос олигопептидов на пептиды или аминокислоты. Известен также катепсин F, который катализирует расщепление протеогликанов. Он ингибируется некоторыми иммуноглобулинами, не чувствителен к действию диизопропилфторфосфата, пепстатина и реагентов, взаимодействующих с группой SH [16, 38].
Во время беременности наблюдается активация протеолиза. В I триместре повышение протеолитической активности может быть связано с происходящими в этот период процессами имплантации и плацентации. II триместр характеризуется завершением периода формирования плаценты и вступлением ее в фазу активного функционирования, что обеспечивает иммуносупрессию. В III триместре увеличение активности ингибиторного звена протеолитической системы может быть связано с нарастанием потенциала свертывания крови, гиперкоагуляцией. Перед родами активация протеолиза связана с повышением фибринолитической активности трофобласта. После родов наблюдается усиление активности ингибиторов протеаз, что может быть расценено как защитная компенсаторная реакция [16].
Катепсин D – важнейшая лизосомальная протеиназа, отражающая способность клеток к ращеплению белков и играющая важную роль в процессе внутриклеточного протеолиза.
Катепсин D существует в виде множественных форм с pI от 5,8 до 7,2 [14, 16]. Максимальная активность отмечена при pH 2,8-4,0.
При гель-фильтрации установлена Mr 42000, а при аналитическом ультрацентрифугировании – 43300. В плаценте протеиназа локализована в ворсинах синцитиотрофобласта.
Катепсин D - эндопептидаза, гидролизующая пептидные связи, образованные остатками гидрофобных аминокислот, один из которых - ароматический. Лучшим субстратом является гемоглобин. Фермент раcщепляет многие природные субстраты: вещество Р, соматостатин, пролактин , b-липотропин, b-эндорфин.
Катепсин D участвует в регуляции развития клетки и ее программируемой гибели, что связано с процессами в системе протеолиз-антипротеолиз, в которой происходит нарушение баланса при ХВГП. Поэтому представляет интерес изучение активности катепсина D при патологическом течении беременности.
1.4. Перекисное окисление липидов и антиоксидантная система фетоплацентарного комплекса при физиологической беременности и хронической внутриутробной гипоксии плода
При физиологической беременности скорость инициированного окисления липидов повышается примерно в 3 раза. Во время беременности в связи с возрастанием основного обмена и увеличением потребления кислорода в крови происходит ряд значительных биохимических изменений: повышается концентрация нейтрального жира, холестерина и липидов [3]. Также увеличивается активность фосфолипазы А2 . В результате ее действия в крови увеличивается концентрация ненасыщенных жирных кислот, которые являются непосредственным субстратом для перекисного окисления [15]. Нарушения в системе перекисного окисления липидов (ПОЛ) и антиоксидантной активности (АОА) являются одним из механизмов формирования антиоксидантной недостаточности вследствие чрезмерного усиления ПОЛ. В результате активации ПОЛ и накопления свободных радикалов происходит нарушение структурно-функциональной целостности клеточных мембран, освобождение лизосомальных ферментов, что в конечном итоге приводит к патологическим процессам в клетке и организме в целом [2, 3, 33]. В настоящее время можно считать в основном расшифрованными механизмы альтерации и реакцию клеточных мембран на повреждение. В конечном итоге они обусловлены свободно-радикальной агрессией и процессами перекисного окисления липидов и белков - важнейших компонентов клеточной стенки [4]. Активатором перекисного окисления служат свободнорадикальные формы кислорода. Субстратом ПОЛ являются полиненасыщенные жирные кислоты (ПНЖК). Дефицит ПНЖК нарушает барьерную и матричную функции клеточных мембран. Об этом свидетельствует повышение параметра упорядоченности липидного бислоя мембраны (микровязкости мембран) [37]. Одновременно с этим отмечено выраженное уменьшение гидрофобности мембран, а, следовательно, увеличение гидрофилии липидного бислоя, и как следствие – его повышенную проницаемость. Нарушение барьерной функции липидного бислоя мембран сопряжено с изменением функционирования каналов для ионов, в первую очередь Са2+ , а также – Na+ , K+ , Mg2+ . Массивный вход Са2+ в клетку приводит к необратимым изменениям в ней, в частности к энергетическому голоду и ее гибели, с одной стороны, а с другой – дополнительно к мышечной контрактуре и вазоспазму. Диеновые коньюгаты, являющиеся первичным продуктом перекисного окисления, увеличивают полярность гидрофобных углеводородных хвостов жирных кислот, которые образуют липидный бислой мембраны. При физиологическом процессе регуляции клеточной активности участки углеводородных хвостов, полярность которых возросла, вытесняются из глубоких слоев мембраны к поверхности, что облегчает процесс самообновления мембраны и влияет на ее проницаемость и ионный транспорт. При избыточном появлении свободнорадикальных форм кислорода самоускоряющееся ПОЛ приводит к полному разрушению ненасыщенных липидов, нарушению структуры и функции белков и других молекул и, как следствие, к гибели клетки [3, 15].
Одним из основных способов неспецифической защиты жизнеспособности органов и тканей является активность антиоксидантных систем, обеспечивающих устойчивость живых клеток к свободнорадикальному повреждению [15, 24]. Исследования последних лет подтвердили, что у женщин с ХВГП напряженность оксидантного стресса, регистрируемая по динамике плазменного уровня общей оксидантной активности, концентрации перекисных липидов и малонового диальдегида (МДА), прогрессивно нарастает к концу 3-го триместра беременности [3, 5, 33].
В АО различают ферментативные (оксидоредуктазные ферменты и антиперекисные ферменты) и неферментативные (низкомолекулярные тиолы, аскорбиновая кислота, токоферол, витамины А, К, Р, убихинон и др.) звенья. Защита структурных биологических мембран осуществляется преимущественно липидными биоантиоксидантами. Активность антиоксидантного фермента глутатионпероксидазы в эритроцитах существенно не изменена как при физиологической беременности, так и при риске невынашивания в обоих критических сроках. Активность глюкозо-6-фосфатдегидрогеназы в ранних сроках беременности повышается значительно. Одновременно уровень токоферола и ретинола снижается в плазме и повышается в плацентарной ткани. [33]. Важными ферментами АОС являются каталаза и церулоплазмин.Церулоплазмин (ЦП)— медьсодержащая оксидаза, относится к альфа-2-глобулиновой фракции плазмы крови человека. Особый интерес вызывают антиоксидантные, иммунорегулирующие, радиопротективные свойства. Благодаря своей высокой ферроксидазной активности ЦП предотвращает неферментативные реакции, дающие начало свободным радикалам и дальнейшему развитию ПОЛ. При физиологических условиях ЦП крови ингибирует ПОЛ на 50%. Подавление ПОЛ достигается за счет перехвата и инактивации супероксидного ион-радикала О2 * [3, 5].
Выявлено увеличение концентрации ЦП у беременных в сравнении с их значениями у небеременных [27, 34]. По-видимому, данный факт объясняется активацией системы ПОЛ при беременности, приводящей в свою очередь к активации антиоксидантной системы защиты организма. Кроме того, выявлено достоверное снижение активности ЦП при ХВГП и гестозах, что может быть объяснено истощением антиоксидантной системы защиты организма в условиях ее напряженного функционирования, вызванного развитием тяжелых осложнений беременности [27, 29, 34, 44].
Каталаза — фермент класса оксидоредуктаз, катализирующий разложение перекиси водорода на воду и молекулярный кислород. При низкой концентрации перекиси каталаза проявляет также пероксидазную активность, окисляя низшие спирты, полифенолы. Одной из основных функций каталазы является защита клеточных мембран от пероксида водорода, образующегося при перекисном окислении липидов [29].
Таким образом, при патологически протекающей беременности наблюдается дисбаланс в системе ПОЛ-АОС. При активации свободно-радикальных процессов на фоне снижения антиоксидантной активности риску повышенной окислительной модификации подвергаются не только липиды, но и белки. В связи с этим вызывает интерес изучение показателей перекисного окисления липидов и антиоксидантной системы в плаценте при ХВГП.
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1. Материалы исследования
Активность катепсина D, содержание пептидов средней молекулярной массы, активность каталазы, церулоплазмина, уровень продуктов перекисного окисления липидов (диеновых и триеновых коньюгатов), уровень гидроперекисей определяли в плацентарной ткани, которую получили сразу после родов. Для исследования брали наиболее удаленную от места прикрепления пуповины ткань. Плацентарную ткань помещали в охлажденный физиологический раствор, очищали от крови и высушивали фильтровальной бумагой. Ткани взвешивали, навески гомогенизировали в стеклянном гомогенизаторе с тефлоновым пестиком.
2.1.1. Клинические группы
Было обследовано 16 образцов плацентарной ткани женщин в возрасте от 20 до 40 лет.
Все родильницы были разделены на 2 группы (рис. 1). Первая группа – женщины с физиологическим течением беременности и родов (n =8), вторая группа – женщины с хронической внутриутробной гипоксией плода (n=8).
Клинические группы

норма ХВГП
Рис. 1. Клинические группы
2.2. Методы исследования
2.2.1. Метод определения активности катепсина D
Для определения активности катепсина D использовали 7,5%-ый гомогенат ткани на натрий-ацетатном буфере (рН 3,3). Препарат фермента (20 мкл) смешивали с 60 мкл 100 мМ натрий-ацетатного буфера (рН 3,3) и преинкубировали 8 мин при температуре 37°С. Начинали реакцию прибавлением в опытные пробы 20 мкл 8% раствора гемоглобина, полученного из бычьей крови. Реакцию останавливали через 40 мин прибавлением 100 мкл 5% раствора трихлоруксусной кислоты. В контрольные пробы добавляли 20 мкл 8% раствора гемоглобина. Пробы центрифугировали 30 мин при 4000 об/мин. После центрифугирования отбирали 100 мкл надосадочной жидкости и определяли количество образовавшегося тирозина методом Лоури. Пробы колориметрировали на КФК-2 при λ=750 нм. Активность фермента определяли как разность в оптической плотности между опытными и контрольными пробами. Активность фермента выражали в нмоль тир, образовавшегося за 1 мин инкубации в пересчете на 1 мг белка. Количество белка в пробах определяли методом Лоури.
2.2.2. Метод определения количества пептидов средней молекулярной массы
Для определения количества пептидов средней молекулярной массы использовали 5%-ый гомогенат ткани. Белки исследуемой биологической жидкости осаждали равным объемом 0,6 М раствора хлорной кислоты. Осадок отделяли центрифугированием при 3000 об/мин в течение 30 мин. Надосадочную жидкость нейтрализовали 3М раствором К2СО3 из расчета 0,2 мл на 1 мл супернатанта. Осадок отделяли центрифугированием при 3000 об/мин в течение 30 мин. Нейтрализованный супернатант разводили в 5 раз. После центрифугирования отбирали 0,5 мл нейтрализованного разведенного супернатанта, в котором определяли количество пептидов средней молекулярной массы методом Лоури. Содержание пептидов средней молекулярной массы выражали в мкг/мл.
2.2.3. Метод определения активности каталазы
Активность каталазы выражается каталазным числом – количеством мг перекиси водорода, которое может разложить 1 мкг крови (гомогената).
В две колбы наливали по 7 мл дистиллированной воды и добавляли в них по 1 мл гомогената. Содержимое контрольной пробы кипятили 2 - 3 мин. В обе колбы вносили по 2 мл 1% раствора H2 O2 и инкубировали 30 мин при комнатной температуре. Затем приливали по 5 мл 10% H2 SO4 и оттитровывали содержимое колб 0,05н раствором KMnO4 до розового цвета.
Расчет: 1мл 0,05 н KMnO4 соответствует 0,85 г H2 O2 . Таким образом, разницу в результатах титрования контроля и опыта умножаем на эту величину и получаем количество мг перекиси водорода, которое может разложить 1 мкл гомогената.
2.2.4. Метод определения активности церулоплазмина
Активность церулоплазмина определяли модифицированным методом Ревина, который базируется на окислении p-фенилендиамина при участии этого фермента. Ферментативную реакцию останавливают добавлением фтористого натрия. По оптической плотности образующихся продуктов судят о концентрации церулоплазмина.
В пробирки вносили по 0,1 мл гомогената. В контрольную пробу добавляли 2 мл раствора NaF (с целью инактивации ферментативной активности церулоплазмина). Затем в контроль и опыт добавляли по 8 мл ацетатного буфера и по 1 мл р-фенилендиамина (используемого в качестве субстрата). Пробирки встряхивали и инкубировали 1 час при температуре, равной +370 С.
После инкубации во все пробирки, за исключением контрольной, доливали по 2 мл раствора фтористого натрия. Содержимое пробирок перемешивали и переносили в холодильник, где выдерживали в течение 30 минут при +40 С.
Пробы колориметрировали на КФК-2 при λ=530 нм. Результаты сравнивали с данными контрольной пробы. Значение оптической плотности умножали на коэффициент пересчета 875.
2.2.5. Метод определения содержания продуктов перекисного окисления липидов (диеновых и триеновых коньюгатов)
Для экстракции липидов брали 1 мл 25% гомогената плацентарной ткани, приливали 3 мл метанола, перемешивали стеклянной палочкой, встряхивали в течение 15 минут, затем центрифугировали при 3000 об/мин в течение 5 минут. Добавляли 3 мл гексана, вновь тщательно перемешивали стеклянной палочкой, встряхивали в течение 15 минут и оставляли отстаиваться на 30 минут.
После разделения слоев, верхний (метанол – гексановый слой) отбирали в сухую пробирку и использовали для исследований.
Уровень диеновых конъюгатов определяли спектрофотометрически при длине волны 233 нм, кетодиенов и сопряженных триенов – 278 нм, ненасыщенных липидов – 220 нм. Рассчитывали содержанимое диеновых конъюгатов, кетодиенов и сопряженных триенов по отношению к уровню ненасыщенных липидов (E233 /E220 и Е278 /Е220 ).
2.2.6. Метод определения содержания гидроперекисей
Для приготовления гомогената использовали буфер 0,025 н трис-HCl (pH 7,4), содержащий 0,175 м KCl. В центрифужные пробирки помещали по 2 мл 25% гомогената и осаждали белки добавлением 0,2 мл 50% раствора ТХУ.
Образовавшийся осадок отделяли центрифугированием в течении 10 минут при 4000 об/мин. Далее 2 мл надосадочной жидкости доводили 96% этанолом до 27 мл, прибавляли 0,2 мл концентрированной соляной кислоты и 0,025 мл 5%-го раствора соли Мора в 3%-ной HCl, пробы интенсивно встряхивали. Через 30 секунд приливали 1 мл 20%-го раствора роданистого калия, после чего развивается малиновая окраска. В качестве контроля использовали пробы, содержащие 96%-ный этанол вместо надосадочной жидкости. Измерение оптической плотности проводили в течение 10 минут после добавления роданистого калия при λ=480 нм.
2.2.7. Статистическая обработка результатов исследования
Достоверность отличий между средними определяли с использованием t-критерия Стьюдента. Корреляционный анализ проводили с помощью программы Статистика (версия 6.0).
ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
3.1. Активность катепсина D в плацентарной ткани в норме и при хронической внутриутробной гипоксии плода
Результаты исследования показали достоверное повышение активности катепсина D плацентарной ткани при хронической внутриутробной гипоксии плода. Отмечено повышение активности фермента при патологии в 1,8 раз по сравнению с нормой (рис.2).
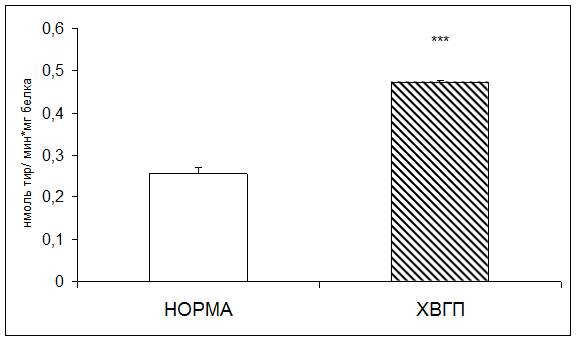
Рис.2. Активность катепсина D в плаценте в норме и при хронической внутриутробной гипоксии плода (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка; * - р<0,05; ** - р<0,01; *** - р<0,001 относительно нормы)
Повышение активности катепсина D плацентарной ткани при хронической внутриутробной гипоксии плода может быть связано с нарушением структурно-функциональных свойств клеточных мембран плаценты при изучаемой патологии.
3.2. Количество пептидов средней молекулярной массы в плацентарной ткани в норме и при хронической внутриутробной гипоксии плода
Согласно результатам исследования при хронической внутриутробной гипоксии плода содержание пептидов средней молекулярной массы в плацентарной ткани повышалось в 1,86 раза по отношению к норме (рис. 3).
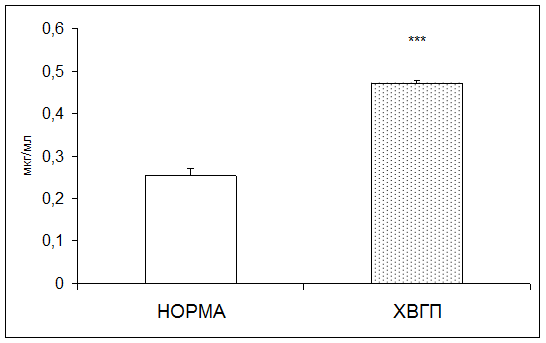
Рис. 3. Содержание пептидов средней молекулярной массы в плаценте в норме и при хронической внутриутробной гипоксии плода (мкг/мл; * - р<0,05; ** - р<0,01; *** - р<0,001 относительно нормы)
Повышение содержания пептидов средней молекулярной массы может быть связано с повышением активности катепсина D[14].
3.3. Активность каталазы в плацентарной ткани в норме и при хронической внутриутробной гипоксии плода
Результаты исследования показали достоверное понижение активности каталазы в плацентарной ткани при хронической внутриутробной гипоксии плода в 1,46 раза по отношению к норме (рис. 4).
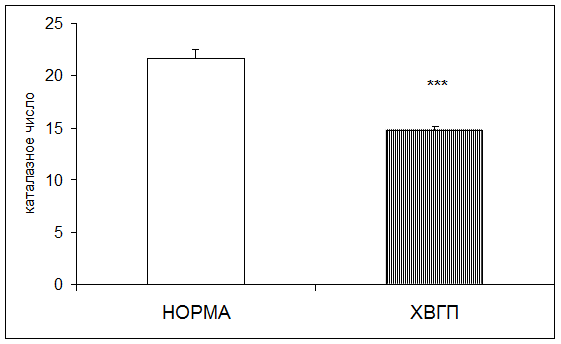
Рис. 4. Активность каталазы в плаценте в норме и при хронической внутриутробной гипоксии плода (каталазное число; * - р<0,05; ** - р<0,01; *** - р<0,001 относительно нормы)
3.4. Активность церулоплазмина в плацентарной ткани в норме
и при хронической внутриутробной гипоксии плода
Согласно результатам исследования при хронической внутриутробной гипоксии плода активность церулоплазмина в плацентарной ткани понижалась в 1,49 раза по отношению к норме (рис. 5).
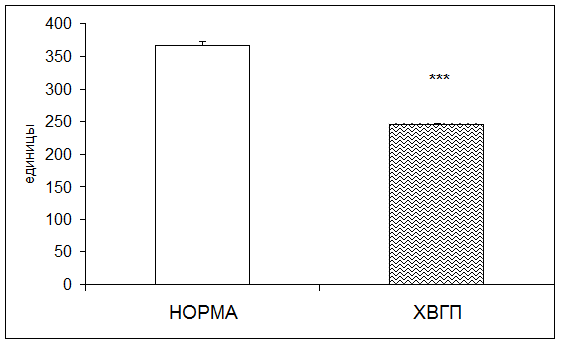
Рис. 5. Активность церулоплазмина в плаценте в норме и при хронической внутриутробной гипоксии плода (единицы; * - р<0,05; ** - р<0,01; *** - р<0,001 относительно нормы)
Вероятно, снижение активности каталазы и церулоплазмина в плацентарной ткани при ХВГП связано с угнетением антиоксидантной системы [31].
3.5. Активность диеновых коньюгатов в норме и при хронической внутриутробной гипоксии плода в плацентарной ткани
Согласно результатам исследования при хронической внутриутробной гипоксии плода активность диеновых коньюгатов в плацентарной ткани понижалась в 1,6 раза по отношению к норме (рис. 6).
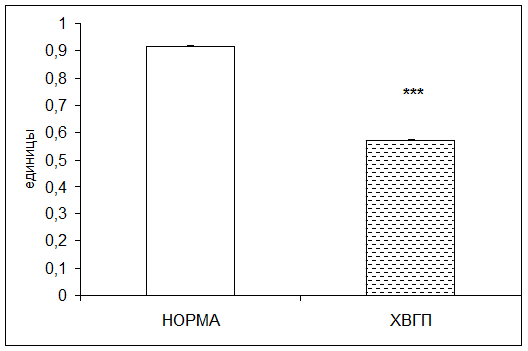
Рис. 6. Активность диеновых коньюгатов в плаценте в норме и при хронической внутриутробной гипоксии плода (единицы; * - р<0,05; ** - р<0,01; *** - р<0,001 относительно нормы)
3.6. Активность триеновых коньюгатов в плаценте в норме и при хронической внутриутробной гипоксии плода
Согласно результатам исследования при хронической внутриутробной гипоксии плода активность триеновых коньюгатов в плацентарной ткани понижалась в 2,1 раза по отношению к норме (рис. 7).
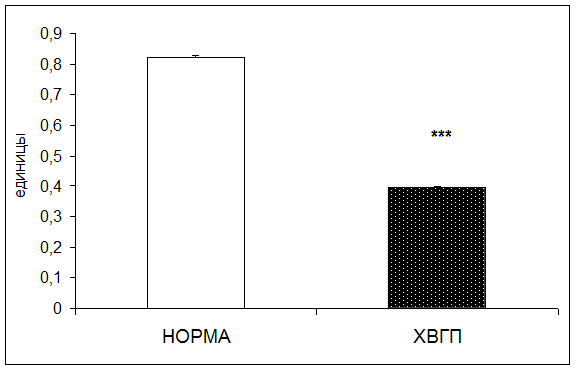
Рис. 7. Активность триеновых коньюгатов в плацентарной ткани в норме и при хронической внутриутробной гипоксии плода (единицы; * - р<0,05; ** - р<0,01; *** - р<0,001 относительно нормы)
Понижение содержания диеновых и триеновых конъюгатов может быть связано с усилением активности низкомолекулярных антиоксидантов – токоферола и ретинола, содержание которых повышено в плацентарной ткани при изучаемой патологии [6].
3.7. Концентрация гидроперекисей в плацентарной ткани в норме и при хронической внутриутробной гипоксии плода
Согласно результатам исследования при хронической внутриутробной гипоксии плода концентрация гидроперекисей в плацентарной ткани повышалась в 1,25 раза по отношению к норме (рис. 8).
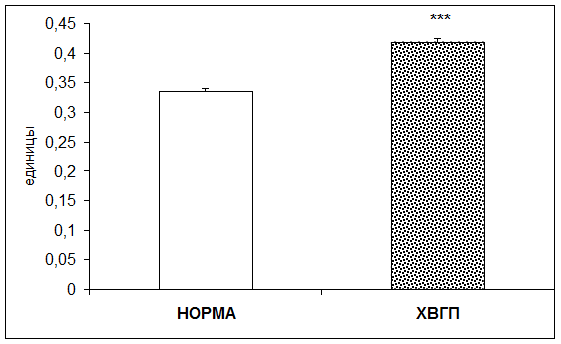
Рис. 8.Концентрация гидроперекисей в плацентарной ткани в норме и при хронической внутриутробной гипоксии плода в плацентарной ткани (единицы; * - р<0,05; ** - р<0,01; *** - р<0,001 относительно нормы)
Повышение содержания гидроперекисей в плацентарной ткани при хронической внутриутробной гипоксии плода, скорее всего, является результатом усиления перекисного окисления липидов на фоне пониженной антиоксидантной активности.
Плацента – основной орган, осуществляющий анатомо-физиологическую связь между матерью и плодом и обеспечивающий гомеостаз в фетоплацентарном комплексе. Различные патологические состояния материнского организма приводят к нарушениям компенсаторно-приспособительных механизмов и, соответственно, к различным формам плацентарной недостаточности. Нарушение транспортной, трофической, эндокринной и метаболической функций плаценты является причиной таких патологий, как гипоксия, гипотрофия и внутриутробная задержка развития плода [46]. Длительное или повторное воздействие повреждающих факторов приводит к чрезмерной активации деятельности плаценты и напряжению всех компенсаторных механизмов. Напряжение в последующем сменяется стадией угнетения, которая характеризуется дезорганизацией основных функций и развитием необратимых деструктивных процессов в плаценте [4], что вызывает интерес к изучению активности катепсинов в данном органе при физиологическом и осложненном течении беременности [16, 38].
Результаты исследования показали достоверное повышение активности катепсина D в плацентарной ткани при ХВГП.
В патогенезе ХВГП одно из ведущих мест занимает нарушение структурно-функциональных свойств клеточных мембран плаценты. При патологическом течении беременности усиливается перекисное окисление липидов на фоне снижения антиоксидантной активности [4].
Согласно результатам исследования при ХВГП в плацентарной ткани отмечено достоверное уменьшение активности каталазы и церулоплазмина по сравнению с нормой. Вероятно, в условиях патологического течения беременности ферментативное звено антиоксидантной системы угнетается и накопливаются токсичные продукты перекисного окисления. Предполагается, что это оказывает влияние на активность фермента, так как обнаружена положительная корреляционная взаимосвязь (КК=0,89** ) между активностями церулоплазмина, каталазы и катепсина D в плацентарной ткани.
Нарушения в системе ПОЛ и АОА являются одним из механизмов формирования антиоксидантной недостаточности вследствие чрезмерного усиления ПОЛ. В результате активации перекисного окисления липидов и накопления свободных радикалов происходит нарушение структурно-функциональной целостности клеточных мембран, в том числе и лизосомальных. Эти процессы приводят к выходу кислых гидролаз в цитозоль. В результате наблюдается усиление процессов аутолиза и дезорганизация практически всех сторон метаболизма. Неконтролируемое нарастание протеолиза вызывает инактивацию ферментов и пептидных гормонов, изменяет их функциональную роль [2, 3, 33].
Кроме того, выявлено достоверное снижение уровня диеновых и триеновых коньюгатов в плацентарной ткани при хронической внутриутробной гипоксии плода по сравнению с нормой.
Это может быть связано с повышением активности низкомолекулярных антиоксидантов (ретинола и токоферрола), содержание которых повышается в плацентарной ткани [6]. Учитывая положительные корреляционные взаимосвязи (КК=0,95** ) уровня диеновых и триеновых коньюгатов с активностью катепсина D, увеличение антиоксидантной защиты можно расценивать как компенсаторно-приспособительную реакцию в условиях хронической внутриутробной гипоксии плода.
В развитии ХВГП важную роль играет дисфункция эндотелия сосудов фетоплацентарного комплекса. Последняя характеризуется снижением выработки эндотелием вазодилататоров, это вызывает спазм сосудов, нарушение микроциркуляции, в результате чего развиваются локальные ишемические изменения в плаценте. Данные процессы ведут к активации ПОЛ, образованию токсичных радикалов (гидроперекисей липидов, диеновых и триеновых коньюгатов). При этом снижена ферментативная антиоксидантная защита (уменьшение активности каталазы и церулоплазмина в плацентарной ткани). Все выше перечисленное способствует нарушению структурно-функциональных свойств клеточных мембран. Необходимо отметить, что согласно литературным данным [2, 3, 6], наблюдается активация звена антиоксидантной системы – токоферола и ретинола, которые, возможно, и способствуют снижению уровней диеновых и триеновых конъюгатов в плацентарной ткани.
Любая патология является стрессом для фетоплацентарной системы. Отмечено повышение уровня КТРФ в плацентарной ткани при патологическом течении беременности [8]. Известно, что КТРФ снижает уровень гонадотропинов [8, 13]. Вероятно, поэтому наблюдается уменьшение уровня ХГЧ, что ведет к угнетению синтеза прогестерона и эстрогенов [20, 32, 48].
Уровни ингибиторов протеолиза a2 - макроглобулина и a1 - антитрипсина регулируются гонадотропными гормонами, эстрогенами, прогестероном [8, 20, 32]. Снижение концентрации эстрогенов и прогестерона в фетоплацентарном комплексе при ХВГП влечет за собой уменьшение активности ингибиторов протеаз, в результате чего наблюдается неконтролируемое нарастание процессов внутриклеточного протеолиза в плаценте с участием катепсинов.
Также было отмечено достоверное повышение содержания пептидов средней молекулярной массы.
Активация внутриклеточного протеолиза приводит к увеличению продуктов протеолиза – молекул малой и средней массы. К числу последних относят пептиды эндогенного происхождения, молекулярная масса которых составляет 300-5000 дальтон. Они образуются в процессе протеолиза в поврежденных клетках при выходе лизосомальных протеолитических ферментов в цитоплазму. Повышенное образование пептидов средней молекулярной массы обнаруживается как при беременности, так и при ее осложнениях. Существенная особенность пептидов средней молекулярной массы заключается в их отчетливо выраженной высокой биологической активности. Накопление среднемолекулярных пептидов приводит к развитию синдрома эндогенной интоксикации [17].
Токсичные продукты эндогенной природы оказывают повреждающее действие на сосудистую систему, ухудшают и без того недостаточное кровообращение. Это усугубляет течение патологического процесса, оказывая негативное влияние на жизнедеятельность всех систем и органов.
Корреляционная взаимосвязь (КК=0,77** ) между активностью катепсина D и содержанием пептидов средней молекулярной массы в плаценте при ХВГП, вероятно, свидетельствует о плохо функционирующей системе антипротеолиза.
Таким образом, катепсин D играет важную роль в патогенезе ХВГП. Последние сопровождаются изменениями со стороны регуляторных механизмов, контролирующих деятельность пептид-гидролаз плаценты. Вероятно, представленные результаты могут быть основой для дальнейшего исследования гомеостаза фетоплацентарной системы и изыскания способов коррекции метаболических изменений в плаценте при патологическом течении беременности.
ВЫВОДЫ
1. Выявлено повышение активности катепсина D в плацентарной ткани при хронической внутриутробной гипоксии плода по сравнению с нормой.
2. Установлено увеличение содержания пептидов средней молекулярной массы в плаценте при хронической внутриутробной гипоксии плода по отношению к норме.
3. Обнаружено снижение активности каталазы и церулоплазмина в плаценте при хронической внутриутробной гипоксии плода по сравнению с нормой.
4. Установлено уменьшение содержания диеновых и триеновых конъюгатов в плацентарной ткани при хронической внутриутробной гипоксии плода по отношению к норме.
5. Выявлено повышение концентрации гидроперекисей в плацентарной ткани при хронической внутриутробной гипоксии плода по сравнению с нормой.
6. Катепсин D участвует в патогенезе хронической внутриутробной гипоксии плода.
ЛИТЕРАТУРА
1. Анастасьева В.Г. Морфофункциональные нарушения фето-плацентарного комплекса при плацентарной недостаточности. – Новосибирск, 1997.
2. Аржанова О.Н., Кошелева Н.Г., Ковалева Т.Г., Громыко Г.Л., Тышкевич О.В. Плацентарная недостаточность: диагностика и лечение // Учебное пособие. Под редакцией Э.К. Айламазяна. – СПб: ИЗДАТ НОРМЕД, 2000.
3. Афанасьева Н.В., Стрижаков А.Н. Исходы беременности и родов при фетоплацентарной недостаточности различной степени тяжести // Вопросы гинекологии, акушерства и перинатологии. – 2007. – Т. 3, № 2
4.Бычков В.И., Образцова Е.Е., Шамарин С.В. Диагностика и лечение хронической фетоплацентарной недостаточности // Акушерство и гинекология. – 1999. – № 6.
5. Ашмарин И.П., Каразеева Е.П. Нейропептиды // в кн. «Нейрохимия» под ред. Ашмарина И.П., Стукалова П.В. – М.: Издательство института биомедицинской химии РАМН, 2006.
6.Д.Б.Юренева. Отделение гинекологической эндокринологии Научного центра акушерства, гинекологии и перинатологии РАМН, Москва. «Постовариэктомический синдром» // Гинекология №1, 2004.
7. О.Р.Григорян. ГУ Эндокринологический научный центр РАМН, Москва. «Современные принципы коррекции метаболического синдрома у женщин в период постменопаузы» // Consilium medicum №9, 2005.
8. И.В.Кузнецова. Кафедра акушерства и гинекологии РМАПО, Москва. «ЗАМЕСТИТЕЛЬНАЯ ГОРМОНАЛЬНАЯ ТЕРАПИЯ» // Consilium medicum №9, 2005.
9.Вовчук К.Л., Чернадчук С.С. Активность тканевых катепсин-В-подобных протеиназ у женщин с онкопатологией тела матки // Укр. биохим. журн. – 2004. – Т. 76, № 2.
10. Запорожан В.Н., Хаит О.В., Низова Н.Н., Скрыпник Н.Н., Рыхлецкий В.Н. Изменение показателей иммунной и протеазно-ингибиторной систем при физиологической беременности // Акушерство и гинекология. – 1992. – № 8-1
11. Айламазян Э.К. Антиоксиданты в комплексной терапии позднего токсикоза и связанной с ним хронической гипоксии плода //Акушерство и гинекология.–1991. – №3.
12.Бандик В. П., Чернокульский С.Т, Яроцкий М. Е., Венцковский Б. М. Ультраструктурные особенности микрососудистого русла терминальных ворсин хориона и плацентарный барьер при поздних токсикозах беременности // ПАГ.— 1994.— № 2.
13. Болдырев А.А., Введение в биохимию мембран. — М.:Наука,1998г.
14. Бурлев В. А. Свободно-радикальное окисление в системе мать—плацента—плод при акушерской патологии // Автореф. дис.... д-ра мед. наук.— М., 1992.
15. Бурмистров С.О., Опарина Т.И., Прокопенко В.М., Арутюнян А.В. Показатели процесса деградации белков и антиокислительной системы при нормальной беременности //Акушерство и гинекология. – 2001 – №6
16. Бычков В.И., Образцова Е.Е., Шамарин С.В. Диагностика и лечение хронической фетоплацентарной недостаточности // Акушерство и гинекология. – 1999. – №6.
17. Ветров В.В., Леванович В.В. Роль молекул средней массы в патогенезе позднего токсикоза беременных // Акушерство и гинекология. – 1990. – № 6.
18. Владимиров Ю. А., Арчаков А. И. Перекисное окисление липидов в биологических мембранах.— М., 1992.
19. Возовик А.В. Коррекция фетоплацентарной недостаточности у беременных с нетоксическим узловым зобом. //Материалы V Российского Форума «Мать и Дитя». – Москва,2003.
20.Воскресенский О. Н. Биофизические и физико-химические исследования в витаминологии // Москва, 1981.
21.Гомазков О.А. Пептиды в кардиологии. – М: Материк Альфа, 2000.
22. Грищенко В. И., Щербина Н. А. Совершенствование диагностики и терапии перинатальной патологии // Акушерство и гинекология. –1990 – № 10
23. Грищенко В. И. Современные методы диагностики и лечения позднего токсикоза беременных.// М., Медицина, 1977.
24. Громыко Г.Л., Шпаков А.О. Современные представления о механизмах регуляции кровообращения в плаценте при физиологической и осложненной беременности // Вестник Российской ассоциации акушеров-гинекологов. – 1995. – № 4.
25. Губский Ю. И., Сильченко И. А., Селезнева А. И. Роль антиоксидантных витаминов в ограничении токсинов. // В кн.: Биофизические и физико-химические исследования в витаминологии.— М.: Наука, 1981.
26.Демидович Е.О., Игнатко И.В. Особенности плодового почечного кровотока при фетоплацентарной недостаточности. //Материалы V Российского Форума «Мать и Дитя», Москва. – 2003.
27.Дмитриев Л. Ф., Давлетина Л. Н., Иванов И. И. Взаимосвязь окислительного фосфорилирования и перекисного окисления липидов // Биологические мембраны — 1985.— Т.2, № 8.
28.Омакин М.С., Арцимович Н.Г. Биологически активные вещества, ассоциированные с плацентой // Акушерство и гинекология. – 1991. – № 9.
29. Кошелева Н.Г., Аржанова О.Н., Громыко Г.Л. и соавт. Новые подходы к лечению угрожающих преждевременных родов //Вестник Российской ассоциации акушеров гинекологов. –1996. – №1.
30. КрайневаТ.К, МорозоваЮ.В, ЕфремоваЛ.М, Шерер Л.А, КачалинаИсследование специфической оксидазной активности сывороточного церулоплазмина у беременных женщин – выпуск Том 51, выпуск 6 –нижегородский медицинский журнал.
31.Орджоникидзе Н. В., Клименко П. А., Дживигелова Г. Д. и др. Новое в лечении беременных с синдромом задержки развития плода // Акушерство и гинекология. –1996. –№ 3.
32.Павлович Л.Л. Патогенетическое обоснование пpименения w-3-полиненасыщенных жиpных кислот пpи осложненном течении беpеменности // Акушерство и гинекология. – 1998. – № 1.
33. Паращук Ю. С., Грищенко О. В., Лахно И. В., Шевченко О. И. Фетоплацентарная недостаточность. Учебное пособие. Харьков: ХГМУ, 1999.
34. Радзинский В.Е., Смалько П.Я. Биохимия плацентарной недостаточности. – М: Издательство Российского университета дружбы народов, 2001.
35. Савельева Г.М., Федорова М.В., Клименко П.А., Сичинава Л.Г. Плацентарная недостаточность. – М.: Медицина, 1991. – 272 с.
36. Сидельникова В.М. Актуальные проблемы невынашивания беременности. М.,1999.
37. Тютюнник В. Л., Бурлев В. А., Зайдиева З. С. Морфофункциональное состояние системы мать—плацента—плод при плацентарной недостаточности и инфекции // Акушерство и гинекология. – 2003. – № 6.
38. Федорова М.В. Плацентарная недостаточность. // Акушерство и гинекология, 1997.
39. Федорова М.В., Калашникова Е.П. Плацента и ее роль при беременности. – М.: Медицина, 1986.
40.Шмагель К. В., Чеpешнев В. А.Плацентаpный лактоген: функции, клиническое значение// Акушерство и гинекология. – 2003. – № 3.
41. Арчаков А.И., Ипатова О.М., Прозоровская Н.Н. Питание и здоровье: биологически активные добавки к пище. М.: Медиа, 1996.
42. Али-заде С.М., Кенгерели Г.С. Липидный обмен, перекисное окисление липидов и антиоксидантная система при гестозе. Деп. рукопись. 1999.
43. Кулаков В.И., Мурашко Л.Е., Бурлев В.А. Клинико-биохимические аспекты патогенеза гестозов. Акушерство и гинекология 1995.
44. Аккер Л.В., Варшавский Б.Я. и др. Показатели оксидантного и антиоксидантного статуса у беременных с гестозом. Акушерство и гинекология 2006.
45. Савельева Г.М. Патогенетическое обоснование терапии и профилактики гестозов. Вестник акушерства и гинекологии 1998.
46. Кущ И.Б. Структурные нарушения эритроцитарных мембран и способ их коррекции у беременных с гестозом. Автореф. дисс. … канд. мед. наук. М., 1988.
47. Коломийцева А.Г., Черненко Т.С. Липиды сыворотки и мембраны эритроцитов у беременных с поздним гестозом. Акушерство и гинекология 1986.
48. Омаров Н.С.-М. Лактационная функция у родильниц с гестозом и железодефицитной анемией. Автореф. дисс. … докт. мед. наук. Махачкала, 2000.
49. Далгатова С.В. Фактическое питание женщин Дагестана, влияние на течение гестации, состояние плода и новорожденного 1 года жизни. М., 1999. 50. Тутельян В.А., Суханов Б.П. Биологически активные добавки в питании человека (оценка безопасности, характеристика, применение в профилактической и клинической медицине). Томск: НТЛ, 1999.